某无色溶液能与铝作用生成氢气,则溶液中可能大量共存的离子组是:
| A.H+、Ba2+、Mg2+、Cl- | B.Cl-、CO32-、Cu2+、Mg2+ |
| C.NO3-、SO42-、K+、H+ | D.NO3-、OH-、Ba2+、Cl- |
对于密闭容器中进行的反应CO(g) + H2O(g)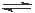 CO2 (g) +H2 (g),达到平衡后,其他条件不变,增大CO的浓度,下列说法不正确的是
CO2 (g) +H2 (g),达到平衡后,其他条件不变,增大CO的浓度,下列说法不正确的是
| A.正反应速率增大 |
| B.逆反应速率减小 |
| C.达到平衡时,逆反应速率比原平衡要大 |
| D.化学平衡常数不变 |
已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12,某溶液中含有C1-, Br-和CrO42-,浓度均为0.010mo1·L-,向该溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
| A.C1-、Br-、CrO42- | B.CrO42-、Br-、C1- |
| C.Br-、C1-、CrO42- | D.Br-、CrO42-、C1- |
常温下,把pH=2的H2SO4和pH=11的NaOH溶液混和,若使混和液pH=7,则酸与碱溶液的体积比是
| A.10:1 | B.1:10 | C.1:2 | D.2:1 |
某原电池的电池反应为:Fe+2Fe3+===3Fe2+,与此电池反应不符的原电池是
| A.铜片、铁片、FeCl3溶液组成的原电池 |
| B.石墨、铁片、Fe(NO3)3溶液组成的原电池 |
| C.铁片、锌片、Fe2(SO4)3溶液组成的原电池 |
| D.铜片、铁片、Fe(NO3)3溶液组成的原电池 |
在298K、100kPa时,已知:①、2H2O(g)=O2(g)+2H2(g) ΔH1
②、Cl2(g)+H2 (g)=2HCl(g) ΔH2
③、2Cl2(g)+2 H2O (g)=4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是
| A.ΔH3=ΔH1+2ΔH2 | B.ΔH3=ΔH1+ΔH2 |
| C.ΔH3=ΔH1-2ΔH2 | D.ΔH3=ΔH1-ΔH2 |