在一定条件下,将1mol CO和2mol 水蒸气混合后发生如下变化:CO(g)+H2O(g) 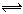 CO2(g)+H2(g), 若反应达平衡时测得CO转化率为40%,则该条件下该反应的平衡常数为
CO2(g)+H2(g), 若反应达平衡时测得CO转化率为40%,则该条件下该反应的平衡常数为
| A.0.25 | B.0.17 | C.0.44 | D.1.0 |
能产生丁达尔效应的分散系是
| A.Fe(OH)3胶体 | B.蒸馏水 |
| C.饱和食盐水 | D.纯净的空气 |
光导纤维的主要成分是
| A.Si | B.SiO2 | C.Na2SiO3 | D.SiCl4 |
下列化学用语的表达正确的是
| A.Na2SO4电离:Na2SO4=Na2++SO42- |
B.Cl-的结构示意图: |
C.质子数为6,中子数为8的微粒: |
| D.医用“钡餐”的化学式:BaSO4 |
下列行为不符合“绿色化学”这一主题的是
| A.推广和鼓励多使用公共交通工具出行 |
| B.大量使用化肥农药,提高农作物产量 |
| C.大力发展太阳能和风力发电 |
| D.对燃煤进行脱硫,减少空气的污染 |
某溶液中可能含有下列5种离子中的几种:Na+、NH4+、Mg2+、Al3+、Cl-。为确认该溶液组成进行如下实验:①取20.0 mL该溶液,加入32.5 mL 4.00 mol•L-1 NaOH溶液加热,有白色沉淀产生,无刺激气味气体生成.过滤、洗涤、干燥,得沉淀2.03 g。再将滤液稀释至100mL,测得滤液中c(OH-)="0.2" mol•L-1;②另取20.0 mL该溶液,加入足量的AgNO3溶液,生成白色沉淀14.35 g。关于原溶液组成结论正确的是
| A.一定含有Mg2+、Al3+、Cl-,不含有Na+、NH4+ |
| B.一定含有Na+、Mg2+、Cl-,不含有NH4+、可能含有Al3+ |
| C.c(Mg2+)为1.75 mol•L-1,c(Na+)为1.50 mol•L-1 |
| D.c(Cl-)为5.00 mol•L-1,c(Al3+)为1.00 mol•L-1 |