能正确表示下列化学反应的离子方程式的是( )
| A.氢氧化钡溶液与硫酸的反应OH-+H+= H2O |
| B.澄清的石灰水与稀盐酸反应 Ca(OH)2 + 2H+= Ca2+ + 2H2O |
| C.铜片插入硝酸银溶液中 Cu + Ag+= Cu2++Ag |
| D.碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2 |
下列各组有机物只用一种试剂无法鉴别的是( )
| A.乙醇、乙酸、乙酸乙酯 | B.苯酚、己烯、四氯化碳 |
| C.对二甲苯、苯、环己烷 | D.乙醛、乙酸、葡萄糖 |
有如下合成路线,甲经二步转化为丙: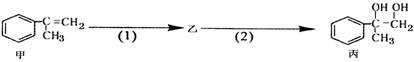
下列叙述错误的是( )
| A.甲和丙均可与酸性KMnO4溶液发生反应 |
| B.反应(1)的无机试剂是液溴,铁作催化剂 |
| C.步骤(2)产物中可能含有未反应的甲,可用溴水检验是否含甲。 |
| D.反应(2)反应属于取代反应 |
有机物A的结构简式如图,它的同分异构体中属于芳香烃的结构共有( ) 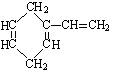
| A.3种 | B.4种 | C.5种 | D.6种 |
结构简式为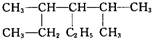 的物质,其名称是( )
的物质,其名称是( )
| A.3,5-二甲基-4-乙基己烷 | B.3-甲基-2,3-二乙基戊烷 |
| C.2-甲基-2,3-二乙基戊烷 | D.2,4-二甲基-3-乙基己烷 |
下列有关化学用语不能表示为2-丁烯的是( )
A.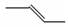 |
B.CH3CH=CHCH3 | C.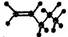 |
D.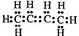 |