实验室用氯化钠固体配制1.00 mol /L的NaCl溶液100 mL,回答下列问题:
1.主要仪器
托盘天平、量筒、烧杯、玻璃棒、胶头滴管,还需要的玻璃仪器是_______________。
2.配制步骤
(1)计算:根据n=c·V,m=n·M ,则m(NaCl)=__________ g。
(2)称量:用托盘天平准确称取NaCl固体__________g。
(3)溶解:将称好的NaCl固体放入烧杯中,用适量蒸馏水溶解;用玻璃棒搅拌,并冷却至室温。
(4)移液:
(5)洗涤:用蒸馏水洗涤烧杯内壁及玻璃棒2-3次,并将洗涤液都注入容量瓶中,轻轻摇动容量瓶,使溶液混合均匀。
(6)定容:将蒸馏水注入容量瓶,当液面距容量瓶颈刻度线1 cm~2 cm时,
改用胶头滴管滴加蒸馏水至凹液面最低处与刻度线相切。
(7)摇匀:盖好瓶塞,反复上下颠倒,摇匀。
右图是该同学转移溶液的示意图,指出图中的错误: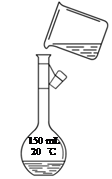
_____________________________________________。
3.若实验遇到下列情况,对NaCl溶液的物质的量浓度有何影响(填写“偏高”、“偏低”或“不变”)?
①为加速固体溶解,可稍微加热并不断搅拌。在未降至室温时,立即将溶液转移至容量瓶定容。 。
②溶解的NaCl溶液转移到容量瓶中后未洗涤烧杯: 。
③定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度。 。
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40mol.L-1的盐酸滴定,滴至终点时消耗盐酸25.0mL。计算该样品中氯的物质的量,并求出FeClx中x值:
(列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe):n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为 。在实验室中,FeCl2可用铁粉和 盐酸反应制备,FeCl3可用铁粉
和 反应制备;
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为
与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为 ,该电池总反应的离子方程式为 。
用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol/LFeCl2溶液,研究废液再生机理。记录如下(a、b、c代表电压值:)
| 序号 |
电压/V |
阳极现象 |
检验阳极产物 |
| I |
x≥a |
电极附近出现黄色,有气泡产生 |
有Fe3+、有Cl2 |
| II |
a>x≥b |
电极附近出现黄色,无气泡产生 |
有Fe3+、无Cl2 |
| III |
b>x>0 |
无明显变化 |
无Fe3+、无Cl2 |
(1)用KSCN溶液检验出Fe3+的现象是_______。
(2)I中,Fe2+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化。写出有关反应的方程式_____。
(3)由II推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有_____性。
(4)II中虽未检测出Cl2,但Cl-在阳极是否放电仍需进一步验证。电解pH=1的NaCl溶液做对照实验,记录如下:
| 序号 |
电压/V |
阳极现象 |
检验阳极产物 |
| IV |
a>x≥c |
无明显变化 |
有Cl2 |
| V |
c>x≥b |
无明显变化 |
无Cl2 |
①NaCl溶液的浓度是________mol/L。
②IV中检测Cl2的实验方法:____________________。
③与II对比,得出的结论(写出两点):___________________。
在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
I:向废液中投入过量铁屑,充分反应后分离出固体和滤液;
II:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
己知:Ksp[Fe(OH)3]= 4.0×10-38
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为 :
(2)过程I加入铁屑的主要作用是 ,分离得到固体的主要成分是 ,从固体中分离出铜需采用的方法是 ;
(3)过程II中发生反应的化学方程式为 ;
(4)过程II中调节溶液的pH为5,金属离子浓度为 。(列式计算)
实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如图1:
(1)为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入 (填“A”或“B”),再滴加另一反应物.
(2)如图2所示,过滤操作中的一处错误是 .
(3)判断流程中沉淀是否洗净所用的试剂是 .高温焙烧时,用于盛放固体的仪器名称是 .
(4)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用图3装置制备.
装置B中盛放饱和NaCl溶液,该装置的主要作用是 .F中试剂的作用是 .用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为 .
烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6—2x]溶液,并用于烟气脱硫研究。
(1)酸浸时反应的化学方程式为 ;滤渣Ⅰ的主要成分为 (填化学式)。
(2)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Al2(SO4)x(OH)6—2x。滤渣Ⅱ的主要成分为 (填化学式);若溶液的pH偏高,将会导致溶液中铝元素的含量降低,
其原因是 (用离子方程式表示)。
(3)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是 ;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将 (填“增大”、“减小”或“不变”)。