下面关于电解质的叙述中错误的是( )
| A.在水溶液里或熔融状态下能够导电的化合物叫做电解质 |
| B.电解质、非电解质都指化合物而言,单质不属于此范畴 |
| C.电解质在水中不一定能导电,能导电的物质不一定是电解质 |
| D.纯水的导电性很差,所以水不是电解质 |
下列物质分子中,所有原子都处于同一平面内的是
| A.CH4 | B.C6H6 | C.CH3—CH3 | D.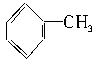 |
对于100mL 1mol/L盐酸与锌粒的反应,采取下列措施能使反应速率加快的是:①升高温度;②改用100mL 3mol/L盐酸;③改用300mL 1mol/L盐酸;④用等量锌粉代替锌粒;⑤滴入少量CuSO4溶液
| A.①③④⑤ | B.①②④⑤ | C.①②③④ | D.①②④ |
放射性同位素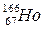 的原子核内的中子数与核外电子数之差是
的原子核内的中子数与核外电子数之差是
| A.67 | B.166 | C.99 | D.32 |
下列递变规律不正确的是
A.Na、Mg、Al还原性依次减弱 B.I2、Br2、Cl2氧化性依次增强
C.C、N、O原子半径依次增大 D.P、S、Cl最高正价依次升高
有关元素的以下内容,随着原子序数的递增,不呈现周期性变化的是
| A.化合价 | B.原子半径 | C.最外层电子排布 | D.相对原子质量 |