有关Na2CO3和NaHCO3的叙述中正确的是
A区别NaHCO3与Na2CO3溶液,Ca(OH)2溶液和CaCl2溶液均可用 .
B.等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同
C.NaHCO3的溶解度比Na2CO3的大
D.Na2CO3固体中混有NaHCO3,高温灼烧即可
在一定条件下,在体积为VL的密闭容器中发生反应:mA + nB 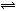 pC。t秒末,A减少了1 mol,B减少了1.25 mol,C增加了0.5 mol。则m ∶ n ∶ p应为
pC。t秒末,A减少了1 mol,B减少了1.25 mol,C增加了0.5 mol。则m ∶ n ∶ p应为
A.4∶ 5∶ 2 B.2∶ 5∶ 4 C.1∶ 3∶ 2 D.3∶ 2∶ 1
C.1∶ 3∶ 2 D.3∶ 2∶ 1
氢气是人类最理想的能源。已知在25℃、101kPa下,1g氢气完全燃烧生成液态水时放出热量142.9kJ,则下列热化学方程式书写正确的是:
| A.2H2 + O2=2H2O△H=" –142.9" kJ/mol |
| B.2H2(g) + O2(g)=2H2O(l)△H=" –" 142.9 kJ/mol |
| C.2H2(g) + O2(g)=2H2O(l)△H=" –" 571.6 kJ/mol |
| D.2H2(g) + O2(g)=2H2O(l)△H =" +" 571.6 kJ/mol |
如图表示可逆反应mA(g) + nB(g)  pC(g)在不同温度(T)、压强(P)下,生成物C的物质的量分数x(C)的变化情况。下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是
pC(g)在不同温度(T)、压强(P)下,生成物C的物质的量分数x(C)的变化情况。下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是
A.吸热反应,m+n<p
B.吸热反应,m+n>p
C.放热反应,m+n<p
D.放热反应,m+n>p
在常温常压下,向10mL 0.01mol/L FeCl3溶液中滴入1mL 0.01mol/L KSCN溶液,可发生反应FeCl3 + 3KSCN 3KCl + Fe(SCN)3,达到平衡后溶液显红色,能使平衡逆向移动的条件是
3KCl + Fe(SCN)3,达到平衡后溶液显红色,能使平衡逆向移动的条件是
| A.向溶液中加少量KCl晶体 | B.向溶液中加入少量水 |
| C.向溶液中滴入数滴 1mol/L FeCl3 | D.设法移走部分水 |
有关合成氨的下列叙述中,不能用勒夏特列原理解释的是
| A.加入催化剂能使合成氨反应速率加快 | B.高压有利于提高NH3的产量 |
| C.温度过高不利于氨的生成 | D.增大N2浓度能提高H2的转化率 |