向含等物质的量两种溶质的甲溶液逐渐加人乙物质,生成不溶物的量(Y)与加人物的量(X)之间的关系符合图所示的是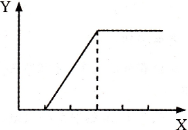
| |
甲溶液 |
乙物质 |
| A |
NaOH和Ca(OH)2 |
CO2气体 |
| B |
H2SO4和MgSO4 |
NaOH溶液 |
| C |
HCl和CaCl2 |
Na2CO3溶液 |
| D |
Fe2(SO4)3和CuSO4 |
Fe粉 |
下列离子方程式不正确的是()
| A.饱和的碳酸钠溶液中滴加少量稀盐酸: CO32-+H+= HCO3- |
| B.向Ca(HCO3)2溶液中加入足量NaOH溶液: Ca2++HCO3-+OH- =CaCO3↓+H2O |
| C.铝粉溶于NaOH溶液中: 2Al+2OH-+2H2O =2AlO2-+3H2↑ |
| D.偏铝酸钠溶液中通入少量的CO2: 2AlO2-+3H2O+CO2=2Al(OH)3↓+ CO32- |
现代建筑的门窗框架常用电解加工成的古铜色硬铝制造。取硬铝样品进行如下实验(每一步试剂均过量),由此可以推知硬铝的组成为()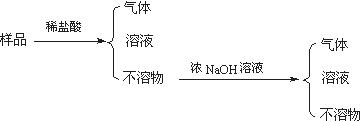
A.Al、Cu、Mg、Si、MnB.Al、Mg、Si、Zn
C.Al、Fe、C、Cu D.Al、Si、Zn、Na
将Cu片放入0.1mol/L FeCl3溶液中,反应一定时间后取出Cu片,溶液中
c(Fe3+):c(Fe2+)=2:3,则溶液中Cu2+与Fe3+的物质的量之比为()
| A.3:2 | B.3:5 | C.4:3 | D.3:4 |
若在加入铝粉能放出氢气的无色溶液中,下列各组离子,可能大量共存的是()
| A.NH4+ NO3- CO32- Na+ | B.Na+ Ba2+ Mg2+ HCO3- |
| C.NO3- K+ Mg2+ Cl- | D.NO3- Na+ K+ Cl- |
现欲完成下列三个实验:①分离汽油和氯化钠溶液的混合物②实验室利用自来水制取蒸馏水③分离单质溴和水的混合物。三个实验采用的方法依次是()
| A.分液、萃取、蒸馏 |
| B.萃取、蒸馏、分液 |
| C.分液、蒸馏、萃取 |
| D.蒸馏、萃取、分液 |