下列离子方程式不正确的是
A.乙酸与碳酸钠溶液反应: 2 CH3COOH +CO → 2CH3COO-+CO2↑+H2O → 2CH3COO-+CO2↑+H2O |
| B.醋酸溶液与新制氢氧化铜反应: 2CH3COOH+Cu(OH)2→Cu2++2CH3COO-+2H2O |
C.苯酚钠溶液中通入少量二氧化碳: 2C6H5O-+CO2+H2O→2C6H5OH+CO |
| D.乙醛溶液与足量的银氨溶液共热 |
CH3CHO+2[Ag(NH3)2] ++2OH- CH3COO-+NH4++2Ag↓+3NH3+H2O
CH3COO-+NH4++2Ag↓+3NH3+H2O
一定条件下,可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),当达平衡时X、Y、Z的浓度分别为0.1 mol·L-1,0.3 mol·L-1,0.08 mol·L-1,则下列判断不合理的是( )
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),当达平衡时X、Y、Z的浓度分别为0.1 mol·L-1,0.3 mol·L-1,0.08 mol·L-1,则下列判断不合理的是( )
| A.c1∶c2=1∶3 | B.平衡时,Y和Z的生成速率之比为3∶2 |
| C.X、Y的转化率不相等 | D.c1的取值范围为0< c1<0.14 mol·L-1 |
在一定温度下的密闭容器中存在如下反应:2SO2+O2 2SO3(g),已知起始时c(SO2)="0.4" mol·L-1,c(O2)=1mol·L-1,经测定该反应在该温度下的平衡常数K=19,当SO2转化率为50%时,该反应将( )
2SO3(g),已知起始时c(SO2)="0.4" mol·L-1,c(O2)=1mol·L-1,经测定该反应在该温度下的平衡常数K=19,当SO2转化率为50%时,该反应将( )
| A.向正反应方向进行 | B.向逆反应方向进行 | C.达到平衡状态 | D.无法判断 |
将0.5molPCl5充入体积为1L的密闭容器中,发生反应PCl5 PCl3+Cl2,一段时间后测得PCl5的浓度为0.3mol/L,且这段时间内的平均反应速率υ(PCl5)= 0.4 mol/(L·min),则这段时间为( )
PCl3+Cl2,一段时间后测得PCl5的浓度为0.3mol/L,且这段时间内的平均反应速率υ(PCl5)= 0.4 mol/(L·min),则这段时间为( )
A.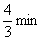 |
B. |
C.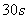 |
D.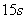 |
把镁条投入到盛有盐酸的敞口容器里,产生H2的速率如图所示,在下列因素中,影响O~t1时间段反应速率的主要因素是( )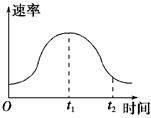
| A.盐酸的浓度 | B.镁条的表面积 | C.Cl-的浓度 | D.溶液的温度 |
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是( )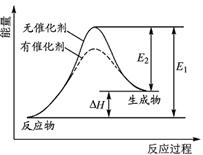
| A.该反应为放热反应 | B.催化剂能改变反应的焓变 |
| C.催化剂能降低反应的活化能 | D.逆反应的活化能大于正反应的活化能 |