下列叙述表示可逆反应N2 + 3H2 2NH3一定处于平衡状态的是……… ( )
2NH3一定处于平衡状态的是……… ( )
| A.N2、H2、NH3的百分含量相等 |
| B.单位时间,消耗a mol N2的同时消耗3mol H2 |
| C.单位时间,消耗a molN2的同时生成3a mol H2 |
| D.反应若在定容的密器中进行,温度一定时,压强不随时间改变 |
下列分离方法中,和物质的溶解度无关的是
| A.萃取 | B.盐析 | C.重结晶 | D.蒸馏 |
下列化学用语正确的是
| A.CO2的结构式:O=C=O |
| B.葡萄糖和淀粉的实验式均为:CH2O |
C.N2H4的电子式: |
D.聚丙烯的结构简式: |
下列电池属于二次电池的是
 |
 |
 |
 |
| A.锌银钮扣电池 |
B.氢氧燃料电池 |
C.铅蓄电池 |
D.锌锰干电池 |
实验室制备氯气:MnO2+4HCl(浓) MnCl2+ Cl2↑+2 H2O反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学设计了4组实验方案(每次均量取20 mL反应残余液进行实验),其中正确的是
MnCl2+ Cl2↑+2 H2O反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学设计了4组实验方案(每次均量取20 mL反应残余液进行实验),其中正确的是
| A.与足量AgNO3溶液反应,过滤、洗涤、干燥,称量生成的沉淀质量为a g |
| B.稀释10倍后取20 mL用已知浓度的NaOH溶液滴定,消耗NaOH的体积为b mL |
| C.与足量NaHCO3固体反应,逸出气体用足量碱石灰吸收,增重c g |
| D.加入d1g CaCO3(过量)充分反应后,称量剩余固体质量为d2 g[已知:Ksp( CaCO3)>Ksp( MnCO3)] |
在一定温度下,将气体X和Y各1.6mol充入10L恒容密闭容器中,发生如下反应: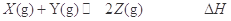
在反应过程中,X的物质的量与时间的关系如下表所示:
| t/min |
0 |
2 |
4 |
6 |
8 |
…… |
16 |
18 |
| n(X)/mol |
1.600 |
1.200 |
1.100 |
1.075 |
…… |
…… |
1.000 |
1.000 |
下列说法不正确的是
A.4~6min时间段内Z的平均反应速率为2.5×10-3mol/(L·min)
B.此温度下该反应的平衡常数K=1.44
C.达平衡后,升高温度, 减小,则正反应
减小,则正反应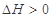
D.若保持其他条件不变,再充入1.6mol Z,达新平衡后Z的体积分数不变