常温下,将3种一元酸分别和NaOH溶液等体积混合,实验数据如下:
| 组别 |
一元酸 |
NaOH |
混合溶液的pH |
| 甲 |
c(HX)="0.1" mol/L |
c(NaOH)=0.1mol/L |
pH = a |
| 乙 |
c(HY)=c1 mol/L |
c(NaOH)=0.1mol/L |
pH = 7 |
| 丙 |
c(HZ)="0.1" mol/L |
c(NaOH)=0.1mol/L |
pH = 9 |
| 丁 |
pH=2 HZ |
pH=12 NaOH |
pH = b |
(1)甲组实验中HX为弱酸,a 7(填“<”,“=”或“>”),
混合溶液中离子浓度由大到小顺序为 。
(2)乙组实验中HY为强酸,则HY溶液的pH= 。
(3)丙组实验发生反应的离子方程式为 ,
所得溶液中由水电离出的c (OH-) = mol/L。
(4)丁组实验中b 7(填“<”,“=”或“>”)。
现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同)。A、B的晶体类型相同。单质A的同素异形体能与B物质发生置换反应。C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同。C、E、F的晶体类型相同,由E构成的物质常温下呈液态。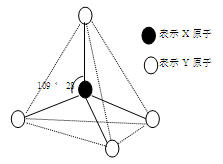
(1)写出单质A的同素异形体与B物质发生置换反应的化学方程式____________;与A同主族的第四周期元素基态原子的外围电子排布式为 。
(2)上述六种物质或粒子的组成元素中有三种处于同一周期,请写出这三种元素第一电离能由大到小的顺序(用元素符号回答)
(3)上述六种物质或粒子中互为等电子体的是(写出化学式)
(4)F分子的中心原子杂化类型是,E易溶于F,其原因是。
A、B、C、D为前四周期元素。A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子。
(1)当n=2时,AB2属于分子(填“极性”或“非极性”)。
(2)当n=3时,A与B形成的晶体属于晶体。
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是(用元素符号表示)。
(4)已知某红紫色配合物的组成为CoCl3·5NH3·H2O。该配合物中的中心离子钴离子在基态时核外电子排布式为,又已知中心离子钴离子的配位数是6,1mol该物质与足量的硝酸银反应可生成3molAgCl,则该物质的配体是。
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为。
一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。①Mn2+基态的电子排布式可表示为 ________。②NO3-的空间构型是________ (用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化为CO2,HCHO被氧化为CO2和H2O。①根据等电子体原理,CO分子的结构式为________。②H2O分子中O原子轨道的杂化类型为________。③1 mol CO2中含有的σ键数目为________。
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型[Cu(OH)4]2-的结构可用示意图表示为________。
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
试回答下列问题:
(1)请写出H的单质与二氧化碳反应的方程式。
(2)D的气态氢化物的VSEPR模型为 _,其中心原子的杂化类型为__ _ _ _ _。
(3)G、H和I的第一电离能数值由大到小的顺序为:(用元素符号作答)。
(4)由A、C、D形成的ACD分子中,含有个σ键,个π键。
(5)要证明太阳上是否含有R 元素,可采用的方法是。
(6)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
①与M同周期的所有元素的基态原子中最外层电子数与M原子相同的元素还有___________(填元素符号)
②MO=Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2是__________(填“极性”或“非极性”)分子。
③在C2H4、CH3Cl、CH2O、CS2、CCl4五种有机化合物中,碳原子采取sp2杂化的分子有___________(填分子式)。
(14分) Ⅰ.工业合成氨与制备硝酸一般可连续生产,回答下列问题:
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g) CO2+H2。T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_______(填计算结果)。
CO2+H2。T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_______(填计算结果)。
(2)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:。
(3)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为。
Ⅱ。甲醇是一种重要的有机化工原料,可用于制取甲醚。一定温度下,在三个体积为1.0L的恒容密闭容器中发生反应:2CH3OH(g) CH3OCH3(g)+ H2O(g)。
CH3OCH3(g)+ H2O(g)。
| 容器编号 |
温度(℃) |
起始物质的量(mol) |
平衡物质的量(mol) |
|
| CH3OH(g) |
CH3OCH3(g) |
H2O(g) |
||
| I |
387 |
0.20 |
0.080 |
0.080 |
| II |
387 |
0.40 |
a |
b |
| III |
207 |
0.20 |
0.090 |
0.090 |
(4)容器I中的反应达到平衡时所需的时间_______(填“大于”“小于”或等于)容器II中的。
(5)a=。
(6)下列说法中能说明该反应达到平衡状态的是。(填字母)
A.容器中压强不变
B.混合气体中c(CH3OCH3) 不变
C.混合气体的密度不变
D.单位时间内生成CH3OH与CH3OCH3的分子个数之比为2:1
(7)已知下面两个反应(m、n均大于0):
反应①:CO(g)+2H2(g)  CH3OH(g) ΔH=-m kJ·mol-1
CH3OH(g) ΔH=-m kJ·mol-1
反应②:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) ΔH= -n kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH= -n kJ·mol-1
则下列m与n的关系中,正确的是(填字母)。
A.n﹥2mB.m﹥2 n C.2m﹥nD.m﹥3n