下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论
是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
下列说法中不正确的是
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B和Cl2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质
在体积一定的密闭容器中,给定物质A、B、C的量,在一定条件下发生反应,建立如下化学平衡:aA(g)+ bB(g) xC(g),符合图(1)所示的关系(C%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图(2)中,Y轴是指
xC(g),符合图(1)所示的关系(C%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图(2)中,Y轴是指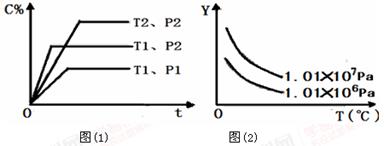
A.反应物A的百分含量 B.反应物B的平衡转化率
C.平衡混合气的密度 D.平衡混合气的总物质的量
某烃的一种同分异构体,核磁共振氢谱测得分子中只有一个吸收峰,则该烃的分子式不可能为
| A.CH4 | B.C5H12 | C.C8H18 | D.C9H20 |
A、B两种烃,不论以何种比例混合,只要混合物总质量一定,燃烧后生成二氧化碳的质量不变,则下列关于A和B的叙述正确的是
A.A和B分子中碳原子个数一定相同 B.A和B不可能是同系物
C.A和B中氢元素质量分数一定相同 D.A和B的化学性质一定相似
右图为某种乙醇燃料电池示意图,工作时电子流方向如图所示,下列判断正确的是
| A.X为氧气 |
| B.电极A反应式:CH3CH2OH-12e-+3H2O=2CO2+12H+ |
| C.电极材料活泼性:A>B |
| D.B电极附近溶液pH增大 |
下列说法正确的是
| A.分子式C7H16的烃,分子中有4个甲基的同分异构体有4种 |
B. 的名称为:2,2,4﹣三甲基﹣4﹣戊烯 的名称为:2,2,4﹣三甲基﹣4﹣戊烯 |
C.化合物 是苯的同系物 是苯的同系物 |
| D.植物油的主要成分是不饱和高级脂肪酸 |