孔雀石主要含Cu2(OH)2CO3,还含少量Fe的氧化物和SiO2,实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下: 
试回答下列问题:
(1)B物质的化学式是 在未加入H2O2的溶液中,存在的金属离子有Cu2+、Fe2+、Fe3+。若检验该溶液中Fe3+,选择最合适的试剂是 (填代号)。
| A.KMnO4溶液 | B.Fe粉 | C.Na2CO3溶液 | D.KSCN溶液 |
(2)向溶液A加入H2O2的作用是 剂(填氧化或还原),离子反应方程式为 ,选用H2O2而不用Cl2的原因是 。
(3)由溶液C获得CuSO4·5H2O,需要经过 ,过滤等操作。除烧杯、漏斗外,过滤操作还需用到另一玻璃仪器是 。
(4)制备CaCO3时,先通入 (填NH3或CO2),若实验过程中有氨气逸出,可选用下列装置中的 (填代号)装置吸收氨气。(烧杯中的液体都为水)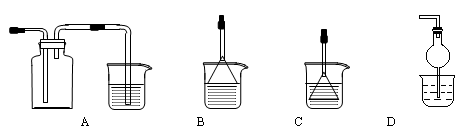
(8分)漂白粉在社会生活、工业生产中用途广泛、漂白粉除了具有漂白作用外,还能杀菌消毒.
(1)5·12汶川大地震后,灾区用水设施受到损毁,水源受到污染,灾区人们的饮用水,必须用漂白粉等药品消毒后才能饮用,以防传染病发生,但瓶装漂白粉久置空气中会呈稀粥状而失去漂白作用.试用化学方程式表示漂白粉在空气中易失效的原因是
①_______________________;②_____________________________.
(2)已知浓盐酸和次氯酸钙能发生如下反应:
Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O
用贮存很久的漂白粉与浓盐酸制得的氯气中,可能含有的杂质气体是( )
①CO2 ②HCl ③H2O ④O2
| A.①②③ | B.②③④ |
| C.②③ | D.①④ |
(1)下图对三种不同类型汽车(以序号1、2、3表示)的废气排放情况进行了比较。废气中的有害成分主要是:碳氢化合物、一氧化碳(CO)、氮氧化物(NOx)、二氧化碳(CO2),这三种汽车分别是以汽油为燃料的汽车、以天然气(主要成分是甲烷)为燃料的汽车和电动汽车。请判断其中序号为1的是________汽车,序号为3的是________汽车。
(2)一氧化氮是大气污染物之一。目前,有一种治理方法是在400°C左右、有催化剂存在的情况下,用氨气把一氧化氮还原为无毒气体。请写出该反应的化学方程式:_______________。
某无色气体A中可能含有H2S、SO2、CO2、HCl气体中的一种或几种
(1)将此气体通入氯水后溶液变得无色透明。
(2)将得到的溶液分为两份:
①其中一份取出少量在试管中加入用盐酸酸化的BaCl2溶液,出现白色沉淀。
②另一份取出少量加入用硝酸酸化的AgNO3溶液,也得到白色沉淀。
试回答:
(1)气体A中肯定含有的气体是________,理由是__________________________________。
(2)气体A中肯定不存在的气体是________,理由是______________________________。
(3)气体A中不能确定是否存在的气体是________________________________________。
在浓硝酸中加入铜片:
(1)开始反应的化学方程式为____________________。
(2)若铜有剩余,则反应将要结束时的反应方程式为___________________________。待反应停止后,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,其原因是(用离子方程式表示)__________________________________。
(9分)A、B、C、D、E可能是NH4Cl、Ba(OH)2、KCl、K2SO4、(NH4)2SO4无色溶液中的一种,将它们两两混合时产生的现象是:
①A和B混合后产生白色沉淀,加热后无明显现象.
②B和C混合也产生白色沉淀,加热后有气体产生,气体使湿润的红色石蕊试纸变蓝.
③B和E混合后无沉淀,但加热后也产生使湿润的红色石蕊试纸变蓝的气体.
④D和任何一种溶液混合后,都无明显变化.根据上述现象,回答:
(1)A:________,B:________,C:________,D:___________,E:________(用化学式表示).
(2)写出有关反应的离子方程式:
A+B:________________________________________________________;
B+C:________________________________________________________;
B+E:_________________________________________________________.