设某省一淡水湖,近来藻类生物疯狂繁殖,特别是蓝藻在多处出现,水质受到严重污染,破坏了生态平衡,请对下列问题提出你的看法:
(1)藻类的生长,说明湖水中哪些元素超标,并说明如何破坏了生态环境。
(2)现在该湖沿岸某电镀厂,每周向湖中排放一次含氰废水,使近岸湖水含CN-的浓度为7.5×10-5 mol·dm-3,CN-与O2作用生成CO2、N2等。写出其反应的离子方程式;并计算每排一次,近岸湖水BOD增大多少?
合成氨原料可以由天然气制取。
其主要反应为:CH4(g)+H2O(g)→CO(g)+3H2(g)
(1)1m3(标准状况)CH4按上式完全反应,产生H2____________mol。
(计算结果保留整数)
(2)CH4和O2的反应为:2CH4(g)+O2(g)→2CO(g)+4H2(g)
设CH4同时和H2O(g)及O2(g)反应。1m3(标准状况)CH4按上述两式完全反应,产物气体的体积V(标准状况)为____________ m3。(填体积取值范围)
(3)CH4和H2O(g)及富氧空气(O2含量较高,不同富氧空气氧气含量不同)混合反应,产物气体组成如下表:
| 气体 |
CO |
H2 |
N2 |
O2 |
| 体积(L) |
25 |
60 |
15 |
2.5 |
计算该富氧空气中O2和N2的体积比V(O2)/V(N2)=
1体积某烃的蒸气完全燃烧生成的CO2比水蒸气少1体积(在同温同压下测定),0.1 m ol该烃完全燃烧的产物被碱石灰吸收,碱石灰增重39 g,则该烃的分子式为?
ol该烃完全燃烧的产物被碱石灰吸收,碱石灰增重39 g,则该烃的分子式为?
有如下化学反应:2A(g)+B(g)
 2C(g),△H<0。
2C(g),△H<0。
(1)若把amolA和bmolB充入一密闭容器中,达到平衡时它们的物质的量满足:
n(A)+n(B)=n(C),求A的转化率;
(2)若将4molA和2molB加入体积可变的等压容器中,一定温度下达到平衡状态,测得气体总物质的量为4.2mol。此时,求混合气体中C的体积分数。
某温度下,将H2和I2各0.10ml的气态混合物充入10L的密闭容器中充分反应,达到平衡后,测得[H2] ="0.0080mol/L" 。
(1)该反应的平衡常数K。
(2)在上述温度下,该容器中若充入H2和I2蒸汽各0.20mol,试求达到平衡状态时各物质的浓度。
如图(a)所示,平行金属板A和B间的距离为d,现在A、B板上加上如图(b)所示的方波形电压,t=0时A板比B板的电势高,电压的正向值为U0,反向值也为U0,现有由质量为m的带正电且电荷量为q的粒子组成的粒子束,从AB的中点O以平行于金属板方向OO'的速度v0=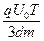 不断射入,所有粒子在AB间的飞行时间均为T,不计重力影响。试求:
不断射入,所有粒子在AB间的飞行时间均为T,不计重力影响。试求:
(1)粒子打出电场时位置离O'点的距离范围
(2)粒子射出电场时的速度大小及方向
(3)若要使打出电场的粒子经某一垂直纸面的圆形区域匀强磁场偏转后,都能通过圆形磁场边界的一个点处,而便于再收集,则磁场区域的最小半径和相应的磁感强度是多大?