现有
| A.二氧化硅 | B.三氧化二铁 |
| C.二氧化硫 | D.三氧化二铝。 |
请你根据已有的知识,选择合适的物质,用字母代号填空:
(1)能形成酸雨的是 ;(2)光导纤维的基本原料 ;
(3)属于两性氧化物的是 ;(4)红棕色固体是 。
已知乳酸的结构简式为 。试回答:
。试回答:
(1)乳酸分子中含有________和_________两种官能团(写名称);
(2)乳酸与足量金属钠反应的化学方程式为
___________________________________________________________________;
(3)乳酸与Na2CO3溶液反应的化学方程式为
___________________________________________________________________;
全球气候变暖已经成为全世界人类面临的重大问题,温家宝总理在“哥本哈根会议”上承诺到2020年中国减排温室气体40%。
⑴地球上的能源主要源于太阳,绿色植物的光合作用可以大量吸收CO2以减缓温室效应,主要过程可以描述分为下列三步(用“C5”表示C5H10O4,用“C3”表示C3H6O3):
Ⅰ、H2O(l)=2H+(aq)+1/2O2(g)+2e-△H=+284kJ/mol
Ⅱ、CO2(g)+C5(s)+2H+(aq)=2C3+(s)△H=+396kJ/mol
Ⅲ、12C3+(s)+12e-=C6H12O6(葡萄糖、s)+6C5(s)+3O2(g)△H=-1200kJ/mol
写出绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式。
⑵有效地开发利用CO2可以降低大气中CO2的含量,目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的恒容密闭容器中,充入1mol CO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)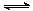 CH3OH(g)+H2O(g) △H=-49.0kJ/mol 。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H=-49.0kJ/mol 。测得CO2和CH3OH(g)的浓度随时间变化如图所示。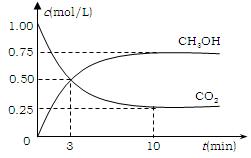
①从反应开始到平衡,氢气的平均反应速率
v(H2)=___________mol/(L·min);
②CO2的转化率=;
③该反应的平衡常数为(保留小数点后2位);
④ 下列措施中能使平衡体系中
下列措施中能使平衡体系中
n(CH3OH)/n(CO2)增大的是___________。
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离出去 | D.再充入1molCO2和3molH2 |
醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠是其常见的盐。
(已知:25℃,醋酸的电离平衡常数Ka(CH3COOH)=1×10-5)。请回答:
⑴写出醋酸钠在水中发生水解反应的离子方程式: ;
;
⑵在CH3COONa溶液中离子浓度由大到小的顺序为
(用“c(Bn+)”表示相应离子浓度);
⑶ 25℃时,醋酸的电离平衡常数表达式Ka=。0.10mol/L的醋酸溶液的pH等于(提示:醋酸的电离常数很小,平衡时的c(CH3COOH)可近似视为仍等于0.10mol/L;);
⑷物质的量浓度均为0.1mol /L的CH3COONa和CH3COOH溶液
/L的CH3COONa和CH3COOH溶液 等体积混合后溶液的PH<7(注:混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是;
等体积混合后溶液的PH<7(注:混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是;
| A.2c(Na+) =c(CH3COO-)+c(CH3COOH) |
| B.c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| C.c(CH3COO-)+c(CH3COOH)=0.1mol/L |
| D.c(Na+)> c(CH3COO-)> c(H+)> c(OH-) |
某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64)。

 按照实验步骤依次回答下列问题:
按照实验步骤依次回答下列问题:
(1)写出装置中锌电极上的电极反应式:;
(2)若装置中铜电极的质量增加0.64g,则导线中转移的电子数目为;
(用“NA”表示)
(3)装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的
K+、Cl-的移动方向表述正确的是。
A. 盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B. 盐桥中的K+向右侧烧杯移动、Cl-向左侧 烧杯移动
烧杯移动
C. 盐桥中的K+、Cl-都向右侧烧杯移动
D.盐桥中的K+、Cl-几乎都不移动
(4)若ZnSO4溶液中含有杂质Cu2+,会加速Zn电极的腐蚀、还可能导致电流在较短时间内衰减。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
A. NaOH B. Zn C. FeD. H2SO4
海水是人类宝贵的自然资源,从海水中可以提取多种化工原料,下图是某工厂对海水资源综合利用的示意图: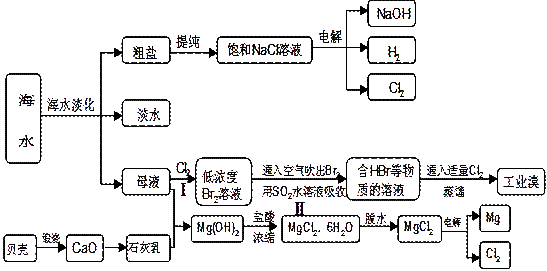
(1)请列举海水淡化的两种方法、。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br—,其目的是:。
步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式
(3)在制取无水氯化镁时需要在干躁的HCl气流中加热MgCl2•6H2O,其原因用化学方程式表示为
(4)上述工艺中可以得到金属M g,请写出工业上冶炼金属铝的化学方程式
g,请写出工业上冶炼金属铝的化学方程式
。