试简述在FeCl3溶液中加入NaOH溶液时的反应现象,并写出有关反应的化学方程式。
现象:______________________________________________;
化学方程式:______________________。
某小组同学用下图装置进行实验研究(a、b、c表示止水夹)。请评价或完善其方案: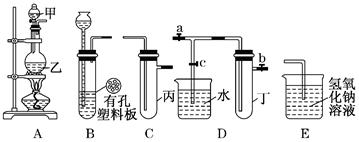
(1)将装置A、C、E相连接,用MnO2和浓盐酸制取氯气,请回答:
①氯元素在周期表中的位置为。
②A中反应的离子方程式:。
③E中氢氧化钠溶液的作用。
在C中加入适量的水可制得氯水.将所得氯水分成两份进行实验,其操作、现象和结论为:
| 实验序号 |
实验操作 |
现象 |
结论 |
| Ⅰ |
将氯水滴入品红溶液 |
品红溶液褪色 |
氯气有漂白性 |
| Ⅱ |
氯水中加入碳酸氢钠粉末 |
有无色气泡产生 |
氯气与水反应的产物具有酸性 |
④实验Ⅰ推出的相应结论是否合理?,若不合理,请说明理由(若合理,无需填写)。
⑤实验Ⅱ推出相应的结论是否合理?,若不合理,请说明理由(若合理,无需填写)。
(2)将B、D、E相连,在B中装浓硝酸和铜片,可制得NO2。B中反应的化学方程式。
如图是某研究性学习小组设计的SO2与Na2O2反应的探究装置.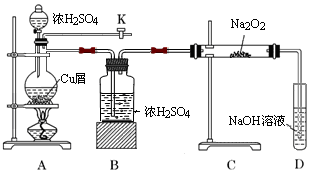
(1)实验开始时,打开旋塞K,通入N2排尽整套装置中的空气,关闭旋塞K。点燃酒精灯,A中反应的化学方程式是。
(2)B装置的作用是。
(3)反应过程中,观察到:A中出现黑色不溶物;C中固体由淡黄色逐渐至完全转化为白色;若将带火星木条伸入D试管口内,火星显得更明亮。
① 停止加热后,再通入N2至整套装置冷却,其目的是。
② 取少量C中白色固体,溶于蒸馏水得无色溶液W 。若向W中滴加几滴酸性KMnO4溶液,振荡,紫色褪去;若向W中加入用盐酸酸化的BaCl2溶液,出现大量白色沉淀;则说明C中白色固体有。
③D装置中发生反应的离子方程式是。
④过滤出A装置中的黑色不溶物,洗涤后将其溶于浓硝酸,得到蓝色溶液并产生红棕色气体;向蓝色溶液中滴加BaCl2溶液,产生白色沉淀;则黑色物质可能是___________。
| A.Cu | B.CuO | C.CuS | D.Cu2S |
已知木炭在一定条件下与浓硝酸反应生成两种+4价的氧化物,为了探究一氧化氮(NO)能否与过氧化钠反应,以及反应后的产物中是否有亚硝酸钠(NaNO2), 某小组同学设计了如图所示装置(夹持仪器和连接用的乳胶管已经省略)。

(1)为了完成该实验,虚线框内还需要连接B~E四套装置,按气流方向连接的顺序为
a→( )( ) →( )( ) →( )( ) →( )( )(填仪器接口的字母编号)。
连接好仪器,检查气密性,装入药品后,要通入一段时间的氮气,再滴加浓硝酸,点燃酒精灯,通人氮气的主要目的是。
(2)简述使用分液漏斗向圆底烧瓶中滴加浓硝酸的操作:。装置E中观察到的主要实验现象有。
(3)装置C的作用是。
(4)某同学经查阅资料后发现亚硝酸是弱酸,性质不稳定,室温下易分解成一氧化氮。装置D中充分反应后,设计实验证明D中是否有亚硝酸钠生成:(写出检验步骤及现象)。
(5)亚硝酸钠在酸性条件下可将I一氧化为I2,该反应常用于亚硝酸钠含量的测定,请写出该反应的离子方程式:。
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡,混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案:
| 编号 |
H2C2O4溶液 |
酸性KMnO4溶液 |
温度/℃ |
||
| 浓度/mol•L-1 |
体积/mL |
浓度/mol•L-1 |
体积/mL |
||
| ① |
0.10 |
2.0 |
0.010 |
4.0 |
25 |
| ② |
0.20 |
2.0 |
0.010 |
4.0 |
25 |
| ③ |
0.20 |
2.0 |
0.010 |
4.0 |
50 |
(1)该反应的离子方程式为;
(2)探究温度对化学反应速率影响的实验编号是(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是;
(3)实验①测得KMn04溶液的褪色时间为40 s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMn04)=mol·L-1·min-1;
(4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25℃时c(Mn04-)~t的变化曲线示意图。
固态化合物A由两种短周期元素组成,可与水发生复分解反应,甲组同学用下图装置(夹持装置略)对其进行探究实验。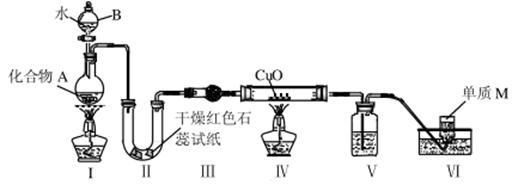
(1)仪器B的名称是____________。
(2)实验中,Ⅱ中的试纸变蓝,Ⅳ中黑色粉末逐渐变为红色并有M生成,则Ⅲ中的试剂为____________;Ⅳ中发生反应的化学方程式为____________________;Ⅴ中的试剂为____________________。
(3)乙组同学进行同样实验,但装置连接顺序为Ⅰ—Ⅲ——Ⅳ—II—Ⅴ——Ⅵ,此时Ⅱ 中现象为_____,原因是____________________________________。
(4)经上述反应,2.5g 化合物A理论上可得0.56L(标准状况)M,则A的化学式为__________。