在氨的工业合成中,有三个关键的技术问题,请结合所学知识解决它们。
(1)合成氨的化学原理是N2+3H22NH3,在工业上选择20~50 MPa的较高压强和450 ℃左右的温度来进行反应,请结合有关的化学原理解释。
(2)在生产过程中需要大量氢气,现有以下几种获得氢气的方法,请你选出最适宜的,并说明理由。
A.电解水制取氢气
B.由煤或焦炭来制取氢气:煤或焦炭经加热,炽热的炭与水蒸气反应生成氢气
C.由天然气或重油制取氢气:天然气的主要成分甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳;一氧化碳在催化剂存在的条件下与水蒸气反应得到氢气和二氧化碳
(3)合成氨的生产工艺流程:首先用适当的方法生产出合成氨的原料气——氮气和氢气。氮气和氢气的混合气体在合成塔中于一定条件下,通过催化剂的作用产生氨气,再通过氨分离器不断地把生成的氨分离出来,同时未转化的反应气体再进入合成塔循环加工。这就是合成氨的工艺流程。请根据这一描述过程画出流程方框图。
草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为:
【提出假设】假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是。
【设计、完成实验】
(1)称取g草酸晶体(H2C2O4·2H2O),配置500mL 0.10mol/L H2C2O4溶液。
①在上述过程中必须用到的2种定量仪器是托盘天平和。
②下列操作会使所配溶液浓度偏低的是(填下列选项的字母序号)。
| A.称取草酸晶体时,将草酸晶体放在托盘天平右盘 |
| B.定容时俯视刻度线 |
| C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水 |
| D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容 |
(2)完成探究,记录数据
| 实验 编号 |
烧杯中所加试剂及用量(mL) |
控制条件 |
溶液褪色时间 (s) |
|||
| 0.10mol/L H2C2O4溶液 |
等浓度 KMnO4溶液 |
H2O |
0.50mol/L 稀硫酸 |
|||
| 1 |
30 |
20 |
30 |
20 |
18 |
|
| 2 |
30 |
20 |
30 |
20 |
水浴控制温度65℃ |
15 |
| 3 |
30 |
20 |
30 |
20 |
加入少量MnSO4固体 |
3.6 |
| 4 |
30 |
20 |
x |
20 |
加入5mL 0.10mol/L K2SO4溶液 |
18 |
则x =,假设2成立。
(3)由于KMnO4能氧化水中有机物等因素,为配制好稳定的KMnO4溶液,其浓度需标定。取10.00 mL 0.10mol/L H2C2O4溶液于锥形瓶中,加入10mL 0.50mol/L稀硫酸,用(2)中KMnO4溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗KMnO4溶液40.00 mL,则草酸溶液与酸性KMnO4溶液反应的离子方程式为:。上述实验中KMnO4溶液的物质的量浓度为。
[化拳——化学与技术](15分)
粉煤灰是燃煤电厂排出的主要固体废物。我国火电厂粉煤灰的主要氧化物组成为SiO2、Al2O3、CaO等。 一种利用粉煤灰制取氧化铝的工艺流程如下: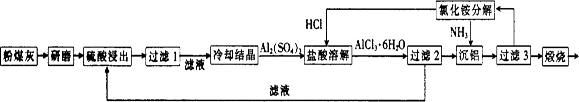
(1)粉煤灰研磨的目的是。
(2)第1次过滤时滤渣的主要成分有(填化学式,下同)和,第3次过滤时滤渣的成分是。
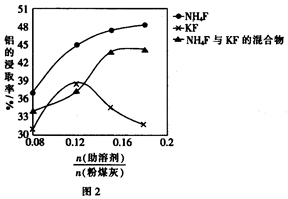
(3)在104℃用硫酸浸取时,铝的浸取率与时间的关系如图1,适宜的浸取时间为h;铝的浸取率与 的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在
的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在 相同时,浸取率最高的是(填化学式);用含氟的化合物作这种助溶剂的缺点是(举一例)。
相同时,浸取率最高的是(填化学式);用含氟的化合物作这种助溶剂的缺点是(举一例)。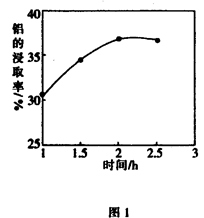
(4)流程中循环使用的物质有和。(填化学式)
(5)用盐酸溶解硫酸铝晶体,再通入HCl气体,析出A1C13·6H20,该过程能够发生的原因是。
(6)用粉煤灰制取含铝化合物的主要意义是。
烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6—2x]溶液,并用于烟气脱硫研究。
(1)酸浸时反应的化学方程式为;滤渣Ⅰ的主要成分为(填化学式)。
(2)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Al2(SO4)x(OH)6—2x。滤渣Ⅱ的主要成分为(填化学式);若溶液的pH偏高,将会导致溶液中铝元素的含量降低,其原因
是(用离子方程式表示)。
(3)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将(填“增大”、“减小”或“不变”)。
元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是。
a.原子序数和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为,氧化性最弱的简单阳离子是。
(3)已知:
| 化合物 |
MgO |
Al2O3 |
MgCl2 |
AlCl3 |
| 类型 |
离子化合物 |
离子化合物 |
离子化合物 |
共价化合物 |
| 熔点/℃ |
2800 |
2050 |
714 |
191 |
工业制镁时,电解MgCl2而不电解MgO的原因是;制铝时,电解Al2O3而不电解AlCl3的原因是。
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
写出SiCl4的电子式:;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式:。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是。
a.NH3b.HIc.SO2d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:。
已知铁生锈的过程为:Fe → Fe(OH)2 → Fe(OH)3 → Fe2O3·xH2O。又知草酸(H2C2O4)分解的化学方程式为H2C2O4 CO↑ + CO2↑ + H2O。某化学小组为测定两种不同生锈铁片的组成(设只含有铁和Fe2O3·xH2O),进行了以下探究,请你参与并完成对有关问题的解答。
CO↑ + CO2↑ + H2O。某化学小组为测定两种不同生锈铁片的组成(设只含有铁和Fe2O3·xH2O),进行了以下探究,请你参与并完成对有关问题的解答。
(1)甲同学利用草酸分解产生的混合气体和下图所示装置测定其中一种锈铁的组成。
主要操作为:取锈铁样品12.6 g置于装置C的硬质玻璃管中,加热完全反应后得到固体的质量为8.4 g,装置D增重8.4 g。
①钢铁在潮湿空气中发生电化学腐蚀时,其负极的电极反应式为。
②装置A的作用是。装置B的作用是。
③根据以上数据能否测定出锈铁的组成?答:(填“能”或“不能”)。
④该装置还存在的一个明显的缺陷是。
(2)乙同学在甲同学装置的基础上将装置D换成装浓硫酸的洗气瓶(装置E,此装置图略),经改进后,重新按甲同学的操作和样品取用量进行实验,若完全反应后得到固体的质量仍为8.4 g,而装置E增重1.8 g,则x =;m(Fe)︰m (Fe2O3·xH2O) =。