在合成氨反应中,入口气体中N2、H2、NH3体积比为6∶18∶1,出口气体中N2、H2、NH3体积比为9∶27∶8,则H2的转化率为____________。
合成氨工业的核心反应是:N2(g)+3H2(g) 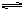 2NH3(g) ΔH="Q" kJ·mol-1,能量变化如图所示,回答下列问题:
2NH3(g) ΔH="Q" kJ·mol-1,能量变化如图所示,回答下列问题: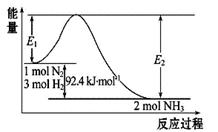
(1)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是: E1_________(填“增大”、“减小”、“不变”)
(2)在500 ℃、2×107 Pa和催化剂条件下向一密闭容器中充入0.5 mol N2和1.5 mol H2,充分反应后,放出的热量_______ 46.2 kJ(填“<”、“>”或“=”)
(3)关于该反应的下列说法中,正确的是_________。
A.ΔH>0,气体分子数目增多 B.ΔH>0,气体分子数目减少
C.ΔH<0,气体分子数目增多 D.ΔH<0,气体分子数目减少
(4)将一定量的N2(g)和H2(g)放入1 L密闭容器中,在500 ℃、2×107 Pa下达到平衡,测得N2为0.10 mol,H2为0.30 mol,NH3为0.10 mol。计算该条件下达到平衡时H2转化为NH3的转化率_________。若升高温度,K值变化_______(填“增大”、“减小”或“不变”)。
(5)在上述(4)反应条件的密闭容器中欲提高合成氨中H2的转化率,下列措施可行的__(填字母)。
A.向容器中按原比例再充入原料气 B.向容器中再充入惰性气体
C.改变反应的催化剂D.分离出氨气
(12分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是。
(2)烧杯间填满碎纸条的作用是。
(3)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等、不相等”),所求中和热(填“相等、不相等”),简述理由。
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会;(填“偏大”、 “偏小”、“无影响”)。
将6.50g锌投入200mL某浓度的盐酸中,锌和盐酸恰好完全反应。求:
(1)所用盐酸中HCl的物质的量浓度c(HCl)=;
(2)反应中生成的H2在标准状况下的体积V(H2)=。
某烧杯中盛有100 mL FeCl3和CuCl2的混合液,混合溶液中c(FeCl3)=1 mol/L,
c(CuCl2)=1 mol/L。请回答:
(1)该混合溶液中铁离子的物质的量为;铜离子的物质的量为;
(2)该混合溶液中氯离子的物质的量n(Cl-)=;
(3)该混合溶液中氯离子的物质的量浓度c(Cl-)=。
有一包白色粉末,含有Ba(NO3)2、CaCl2、K2CO3中的2种。为确定其成分,现做以下实验。结合资料卡片中的物质溶解性,试分析:
资料卡片:一些物质的溶解性
| OH- |
CO |
Cl- |
NO |
|
| Na+ |
溶 |
溶 |
溶 |
溶 |
| Ca2+ |
微 |
不 |
溶 |
溶 |
| Ba2+ |
溶 |
不 |
溶 |
溶 |
| Mg2+ |
不 |
微 |
溶 |
溶 |
(1)将少量白色粉末加入足量水中,振荡,有白色沉淀生成。
通过上述现象可初步判断原白色粉末中一定含有的物质是(填化学式)。
(2)过滤得到(1)中所产生的白色沉淀及滤液。
实验室中进行过滤操作时,通常需要下列玻璃仪器中的(填序号)。
a. 玻璃棒 b. 普通漏斗 c. 烧杯 d. 容量瓶
(3)再继续向滤液中加入AgNO3溶液和过量稀硝酸,最终有白色沉淀生成。
第(3)步实验及现象说明,原白色粉末中一定还含有的物质是(填化学式),若将(2)中的白色沉淀溶于稀硝酸时,发生反应的化学方程式是
。