为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验。
| 实验编号 |
实验操作 |
实验现象 |
| ① |
分别在试管A、B中加入 5 mL 5%(溶液浓度) H2O2溶液,各滴入2 滴相同浓度的CuSO4溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。 |
试管A中不再产生气泡; 试管B中产生的气泡量增大。 |
| ② |
另取两支试管分别加入5mL 5%H2O2溶液和5 mL 10%H2O2溶液 |
试管A、B中均未明显见到有气泡产生。 |
(1)过氧化氢分解的化学方程式为 。
(2)实验①的目的是 。
实验中滴加CuSO4溶液的目的是 。
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你设计的实验方案是 。(用实验中所提供的几种试剂)。
(4)对于H2O2分解反应,Fe2(SO4)3溶液也有一定的催化作用。为比较Fe2(SO4)3和CuSO4溶液对H2O2分解的催化效果。某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题: 
如图所示,同学们分别从定性和定量角度进行了比较。
①定性分析:如图甲可通过观察 ,定性比较得出结论。
②定量分析:用图乙所示装置做对照试验,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是 。
(5)通过对上述实验过程的分析,在实验设计时,要考虑_________方法的应用。
学习氢氧化钠的性质之后,知道氢氧化钠溶液中含有H2O、Na+、OH-,能使无色酚酞溶液变红色,某科技小组想进一步探究是哪一种粒子使无色酚酞溶液变红色。
【提出猜想】猜想①:可能是H2O;
猜想②:可能是Na+;
猜想③:可能是OH-。
【实验验证】
| 实验操作 |
实验现象 |
结论 |
| ①用试管取少量蒸馏水,滴入1滴~2滴无色酚酞溶液,振荡 |
试管内溶液仍为无色 |
水分子不能使无色酚酞溶液变红色 |
| ②用试管取少量氯化钠溶液,滴入1滴~2滴无色酚酞溶液,振荡 |
||
| ③用试管取少量氢氧化钠溶液,滴入1滴~2滴无色酚酞溶液,振荡 |
【讨论反思】有同学认为猜想①不需要实验验证就可以排除,你认为该同学的理由是__________________________。
实验室新进一批浓硝酸,化学兴趣小组为研究该试剂的保存方法,开展相关探究。请根据要求回答问题:
(1)打开盛装浓硝酸的试剂瓶,立即观察到瓶口有白雾产生。据此可知,浓硝酸具有_________(填一条物理性质)。为进一步证明浓硝酸具有该性质,兴趣小组设计如图装置(脱脂棉团因喷有稀氢氧化钠与酚酞混合液而呈红色)进行实验,实验过程中将观察到的现象是__________________,发生反应的化学方程式为_____________。
(2)将少量浓硝酸置于试管中,采用强光照射或者稍加热,立即观察到溶液上方有红棕色气体产生。据此现象可推知浓硝酸具有_________(填一条化学性质)的性质。
(3)通过上述两个实验可知,实验室应如何保存浓硝酸?__________________。
在两支试管中各加入2 mL水,然后分别加入1~2小粒碘或高锰酸钾,振荡,观察现象;然后再向两支试管中分别加1 mL汽油,振荡,静置,观察现象。记录如表所示:
| 溶剂 |
溶质 |
现象 |
| 先加水 |
碘 |
底部仍有碘固体,液体呈浅黄色 |
| 先加水 |
高锰酸钾 |
底部无固体,溶液呈深紫色 |
| 再加汽油 |
碘 |
分层,上层呈深紫色,下层近无色,底部无固体 |
| 再加汽油 |
高锰酸钾 |
分层,上层无色,下层呈深紫色,底部无固体 |
请回答:
(1)加入汽油后,投入碘的试管的上层液体名称是_________;投入高锰酸钾的试管的下层液体的名称是_____________________。
(2)从实验现象可以归纳:碘的溶解性为______________,高锰酸钾的溶解性为____________________。
(3)在科学研究中,若将大量水中溶解的少量碘“富集”起来,你认为可以采取的方法是__________________。
铁、铝、铜是常见的三种金属。同学们发现生活中的铝和铜制品表面一般不用防锈,而铁制品一般需要做防锈处理。
【提出问题】这是不是因为铁、铝、铜三种金属中铁的活动性最强呢?
【实验探究】同学们对这三种金属的活动性顺序展开了探究,请你参与探究并填写空格。
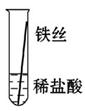
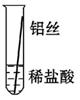
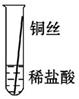
将粗细相同的铁丝、铝丝、铜丝分别插入体积相同、溶质质量分数也相同的稀盐酸中:
| 操作 |
 |
 |
 |
根据现象得出金属活动性顺序 |
| 片刻后现象 |
有少量气泡 |
无气泡 |
无气泡 |
Fe>Al,Fe>Cu |
| 几分钟后现象 |
有少量气泡 |
有大量气泡 |
无气泡 |
【讨论交流】为什么同一个实验得出了两种结论呢?同学们带着这个疑问查阅了相关资料,明白了铝丝在稀盐酸中短时间内无气泡,是因为铝表面致密的氧化膜会先与盐酸反应。
【反思评价】做金属性质实验时需将金属进行打磨,打磨的目的是________。
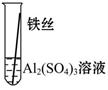
【实验验证】为了进一步确认铁、铝、铜这三种金属的活动性顺序,同学们又将两根粗细相同的、打磨过的铁丝分别插入硫酸铝溶液、硫酸铜溶液中:
| 操作 |
 |
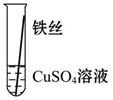 |
根据现象得出金属活动性顺序 |
| 现象 |
无明显现象 |
Al>Fe>Cu |
写出铁与硫酸铜溶液反应的化学方程式_________________。
【拓展迁移】(1)若只有一支盛有少量稀盐酸的试管,只需合理安排金属丝的插入顺序(能与盐酸反应的要一次将盐酸消耗完),也能证明铁、铝、铜这三种金属的活动性顺序。金属丝的插入顺序为________________。
(2)金属被人类大规模开发利用的大致年限也与金属活动性顺序有关,请写出铁、铝、铜三种金属材料被人类利用的先后顺序________________。
下面是对铁的锈蚀条件的探究。因通常实验中铁生锈所需要时间较长,某实验小组设计了如图所示的改进实验。
(1)检查装置的气密性:连接好装置,关闭分液漏斗的旋塞,将C导管接入到装有水的烧杯中,微热甲装置,说明气密性良好的现象是___________________。
(2)反应开始后,甲装置中的反应现象:_______________________,MnO2的作用:__________________。
(3)4分钟后观察:A处铁丝依然光亮,B处铁丝表面灰暗,D处铁丝依然光亮,A、B处实验现象对比,可得出铁生锈与____________有关;B、D处实验现象对比说明:决定铁生锈快慢的一个重要因素是________________________。