氢气的燃烧产物是水,被认为是最清洁的燃料。北京街头已经出现了以氢气作为燃料的公交车,据该车设计师介绍:“只要你愿意,燃烧生成的水可以直接饮用”。请你计算1kg氢气燃烧产生纯水的质量。
某兴趣小组的同学研究(Cu-Zn合金)样品中锌的含量,取该样品18g跟足量的稀硫酸充分反应,产生氢气的质量与所用稀硫酸的质量关系如下图所示。请计算: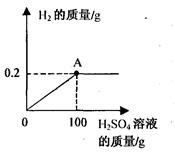
(1)该样品中锌的质量为 。
(2)所用稀硫酸的溶质质量分数(要有规范的计算过程)。
(3)图中A点时,反应后所得溶液的溶质质量分数为 。(保留1位小数)。
黄石市华新水泥厂化验室,为了测定某矿山石灰石中碳酸钙的质量分数,取石灰石样品与足量稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸反应也不溶于水。)有关实验数据如下表:
| 反应前 |
反应后 |
||
| 实验数据 |
烧杯和稀盐酸的质量 |
石灰石样品的质量 |
烧杯和其中混合物的质量 |
| 150 g |
12 g |
157.6 g |
|
(1)根据质量守恒定律可知,反应中生成二氧化碳的质量为 g。
(2)求该石灰石中碳酸钙的质量分数。
目前市场上的补钙药剂很多,下图是某品牌补钙药品的部分说明书.
为测定其含量是否达标,某兴趣小组的同学取10片钙片研碎后放于烧杯中,将100g稀盐酸分五次加入到烧杯中,并不断搅拌,称量,将得到的有关数据记录如下(钙片中其它成分不与稀盐酸反应):
| 加入稀盐酸的质量/g |
0 |
20 |
40 |
60 |
80 |
100 |
| 烧杯中剩余物质质量/g |
10 |
29.12 |
48.24 |
67.36 |
86.48 |
106.48 |
请你根据题给信息和表中数据,回答下列问题:
(1)实验过程中将钙片研碎的目的是: .
(2)完全反应后,产生二氧化碳的质量为 g.
(3)试通过计算说明,该品牌钙片含量是否达标.(写出计算过程)
(4)如果按用量服用,服用者每天通过该补钙剂摄入钙元素的质量为 g.
金属在生产和生活中具有广泛的应用。
(1)地壳中含量最高的金属元素是 (写元素符号,下同);人体中含量最高的金属元素是 。
(2)铁制品容易锈蚀,用稀盐酸除铁锈的化学方程式为 。
(3)铁矿石冶炼成铁是一个复杂的过程。把铁矿石、焦炭和石灰石一起加入 ,在高温下,利用其中反应生成的 把铁从铁矿石中还原出来。
(4)炼钢过程中,检验员提取5g钢样,在足量的氧气中充分燃烧,将生成的气体用足量的澄清石灰水充分吸收,得到0.25g白色沉淀。求:①该钢样燃烧时生成二氧化碳的质量;②该钢样中碳的质量分数。
(写出计算过程)
把干燥的氯酸钾和二氧化锰的混合物15.5克装入大试管,加热制取氧气,当反应不再发生后,冷却、称量,得10.7克固体物质。试计算:
(1)生成氧气的质量是多少?
(2)反应后剩余固体含哪些物质?其质量分别为多少?