磷脂含有一个非极性基团和一个极性基团,水溶性的磷脂有重要的生物学功能。磷脂是甘油酯的一个 被
被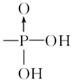 代替后,再与碱反应生成的产物。试将软脂酸和甘油转化成含Na+的磷脂。
代替后,再与碱反应生成的产物。试将软脂酸和甘油转化成含Na+的磷脂。
(1)________、(2)________、(3)________。
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
 (1)合成氨反应反应N2(g)+3H2(g)
(1)合成氨反应反应N2(g)+3H2(g)  2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡移动(填“向左”“向右”或“不”);,使用催化剂反应的ΔH(填“增大”“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡移动(填“向左”“向右”或“不”);,使用催化剂反应的ΔH(填“增大”“减小”或“不改变”)。 (2)O2 (g)= O+2(g)+e-
(2)O2 (g)= O+2(g)+e- H1="+" 1175.7 kJ·mol-1
H1="+" 1175.7 kJ·mol-1 PtF6(g)+ e-1
PtF6(g)+ e-1 PtF6-(g)
PtF6-(g) H2=" -" 771.1 kJ·mol-1
H2=" -" 771.1 kJ·mol-1 O2+PtF6-(s)=O2+(g)+PtF6-
O2+PtF6-(s)=O2+(g)+PtF6-  H3="+482.2" kJ·mol-1
H3="+482.2" kJ·mol-1 则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的
则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的 H="_____________" kJ·mol-1。
H="_____________" kJ·mol-1。 (3)在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。 (4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4*)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4*)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________。
氢氧燃料电池是符合绿色化学理念的新型发电装置。
下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,
性质稳定,请回答: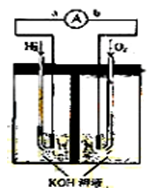
 (1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 (用a、b 表示)。
(用a、b 表示)。 (2)负极反应式为 。
(2)负极反应式为 。 (3)电极表面镀铂粉的原因为 。
(3)电极表面镀铂粉的原因为 。 (4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下: Ⅰ2Li+H2
Ⅰ2Li+H2 2LIH
2LIH Ⅱ.LiH+H2O==LiOH+H2↑
Ⅱ.LiH+H2O==LiOH+H2↑ ①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。 ②已知LiH固体密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
②已知LiH固体密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。 ③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。


 现有A、B、C、D、E、F六种化合物,已知它们的阳离子有
现有A、B、C、D、E、F六种化合物,已知它们的阳离子有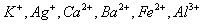 阴离子有
阴离子有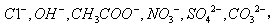 现将它们分别配成
现将它们分别配成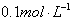 的溶液,进行如下实验:
的溶液,进行如下实验:
①
 测得溶液A、C、E呈碱性,且碱性为A>E>C;
测得溶液A、C、E呈碱性,且碱性为A>E>C;
②
 向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③
 向D溶液中滴加
向D溶液中滴加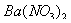 溶液,无明显现象;
溶液,无明显现象;
④
 向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
 根据上述实验现象,回答下列问题:
根据上述实验现象,回答下列问题:
(1)
 实验②中反应的化学方程式是
实验②中反应的化学方程式是
 ;
;
 (2)E溶液是,判断依据是
(2)E溶液是,判断依据是
 ;
;
 (3)写出下列四种化合物的化学式:A、C、
(3)写出下列四种化合物的化学式:A、C、
 D、F.
D、F.
A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。 
(1)若X是空气中存在的强氧化性无色气体单质,则A可能是___________(填序号)
a.C b.Na c.S d.Al
(2)若X是日常生活中最常用的金属单质,A是气体单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,X在气体A中燃烧产生棕黄色的烟。
B的化学式为____________;反应②的化学方程式为:,
C溶液中加入NaOH溶液后产生的现象是, 方程式为。
(16分)
(1)实验室少量的金属钠保存在中,取用时用到的仪器和用品有, 剩余的钠应;将一小块钠投入到硫酸铜溶液中,反应的离子方程式为,观察到的现象为(填写标号)。
a.钠浮在液面上四处游动b.钠融成了一个闪亮的小球
c.溶液中有蓝色沉淀生成 d.溶液中有红色固体析出
(2)实验室制氯气的化学反应方程式为_________________________________;氯气为有毒气体,需用氢氧化钠溶液进行尾气处理,请完成该离子方程式, 该原理还可用于工业制。
(3)下列物质既能与酸反应,又能与碱反应的是
a. Al b. Mg c. CH3COONH4 d. NaHCO3 e. Al2O3