被严重腐蚀了的铜和铁共同放入盐酸中充分反应后,剩余残渣中只有铜,则溶液中含有的金属阳离子为( )
| A.可能只含Fe2+ |
| B.可能只含Cu2+ |
| C.一定含有Fe2+和Cu2+ |
| D.可能只含Cu2+和Fe3+ |
酯X完全燃烧生成的CO2和H2O的物质的量之比为1:1,X水解可得羧酸B和醇C,C氧化后可得羧酸D,且B和D是同分异构体,则酯X是
| A.CH3CH2COOCH(CH3)2 | B.CH3CH2COOCH2CH=CH2 |
| C.(CH3)2CHCOOCH2CH(CH3)2 | D.CH3CH2CH2COOCH2CH(CH3)2 |
如图是一种分子式为C4H8O2的有机物的红外光谱图,符合条件的有机物有
| A.2种 | B.3种 | C.4种 | D.5种 |
下列说法中正确的是
A.CCl4的比例模型示意图为 |
B.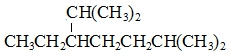 的名称为2,6-二甲基-3-乙基庚烷 的名称为2,6-二甲基-3-乙基庚烷 |
C.化合物 有4种一氯代物 有4种一氯代物 |
D.1 mol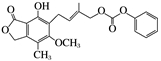 最多能与4 mol NaOH完全反应 最多能与4 mol NaOH完全反应 |
由1-丙醇制取 ,最简便的流程需要下列反应的顺序应是
,最简便的流程需要下列反应的顺序应是
a.氧化 b.还原 c.取代 d.加成 e.消去 f.中和 g.缩聚 h.酯化
| A.b、d、f、g、h | B.e、d、c、a、h |
| C.a、e、d、c、h | D.b、a、e、c、f |
最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
下列说法中正确的是
| A.CO和O生成CO2是吸热反应 |
| B.在该过程中,CO断键形成C和O |
| C.CO和O生成了具有极性共价键的CO2 |
| D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程 |