如图所示是电子工业中某原料的生产流程。其中反应②③你可能不熟悉,其目的是为了提纯B;物质A~H均由短周期元素构成;G是五原子分子;A~D均是单质且元素原子的最外层电子数目的关系为C>A=B>D;H极易溶于水,且其水溶液是一种强酸。
请回答下列问题:
(1)H的电子式________;G的化学式为________。
(2)③所属的反应类型是________。
(3)反应①的化学方程式为_______________________________________。
(4)F在工业上有多种用途,写出其中一种用途的化学方程式:_____________________。
下图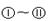 分别代表有关反应中的一种物质,请填写以下空白。
分别代表有关反应中的一种物质,请填写以下空白。
(1)已知①中阴阳离子个数比为1:1,则的化学式是、②的电子式为。
(2)上图中涉及的氧化还原反应共有个。
(3)与反应的化学方程式为。
(4)⑧与⑨反应的化学方程式是。
(5)一定条件下,将2amL和的混合气体用排水法收集,得到amL气体,则原混合气体中和的体积比为。
(13分)有一包白色固体粉末,可能含有CuSO4、Ba(NO3)2、Na2SO4、K2CO3、KCl中的一种或几种,按以下步骤进行实验:
①将该固体粉末溶于足量水中得无色溶液和白色沉淀
②加入足量稀硝酸,沉淀部分溶解并有气体产生
根据以上实验现象推断:
(1)该白色粉末中一定含有;一定不含有;可能含有(写化学式)
(2)生成白色沉淀的离子方程式为:、
(3)沉淀加入稀硝酸反应的离子方程式为:
(4)要确定可能含有的物质,还需要进行的实验操作是
甲、乙、丙为常见单质。A、B、C、D、E、F、G、H均为中学化学中常见的化合物,其中B、G的焰色反应均为黄色,C能使品红溶液褪色。在一定条件下,各物质相互转化关系如图所示。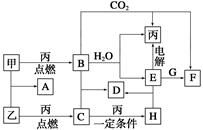
请回答下列问题:
(1)用化学式表示:丙为__________,H为__________。
(2)A的电子式为___________________________________________________。
(3)电解E的水溶液时,E起到的作用是_______________________________。
(4)写出B+C―→D的化学方程式:__________________________________;
写出E+G―→F的离子方程式:____________________________________。
A、B、C、D是四种常见的单质,A、B为金属;C、D常温下是气体,且D为黄绿色气体。甲、乙、丙为常见的化合物,甲物质具有磁性。它们之间有如图的转化关系: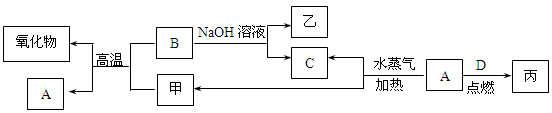
请回答下列问题:
(1)B与甲反应的化学方程式是。
B与NaOH溶液反应的离子方程式是。
甲与足量盐酸溶液反应的离子方程式是。
(2)含有B的阳离子的溶液与乙溶液反应得到一种白色沉淀,该反应的离子方程式是。
(3)实验室检验丙溶液中所含金属阳离子的操作方法和现象是。
已知下图中物质M是由同一短周期的两种元素组成的离子化合物,焰色反应为黄色,阴离子元素最高正价与它的负价代数和为6。X具有漂白性,Y为碱性气体, W是对空气无污染的气体。试回答下列问题:
(1)写出电解M溶液①的化学方程式。
(2)写出实验室制取Y气体的化学方程式。
(3)若A是一种常见金属,写出反应②的化学方程式。
(4)若A是某元素的一种常见酸性氧化物,写出反应③的离子方程式。
(5)写出X的电子式和Z的结构式。
(6)写出反应⑤的化学方程式。
(7)标准状况下反应⑥中生成11.2L W时转移的电子数。(用NA表示阿佛加德罗常数)