在pH=1的某溶液中,可能存在 、I-、Fe3+中的一种或两种,向该溶液中滴入Br2,单质Br2被还原,由此推断该溶液里,上述三种离子中一定存在的离子为( )
、I-、Fe3+中的一种或两种,向该溶液中滴入Br2,单质Br2被还原,由此推断该溶液里,上述三种离子中一定存在的离子为( )
A. 、Fe3+ 、Fe3+ |
B.只有 |
C.I-、Fe3+ | D.只有I- |
中学化学教材中,常借助于图像的这一表现手段清晰地突出实验装置的要点、形象地阐述化学过程的原理。下列有关化学图像表现的内容正确的是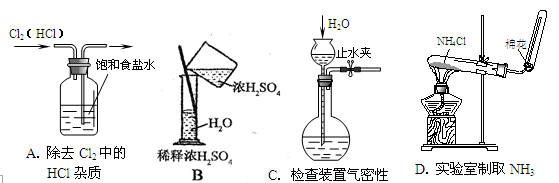
X、Y、M、N是短周期主族元素,且原子序数依次增大。已知X的最外层电子数是电子层数的3倍,X、M同主族,Y的原子在短周期主族元素中原子半径最大。下列说法正确的是
| A.M与X形成的化合物对应的水化物一定是强酸 |
| B.Y2X和Y2X2中阴、阳离子的个数比相同,化学键类型也完全相同 |
| C.X、Y的简单离子半径:r(X2-)>r(Y+) |
| D.M的气态氢化物比N的气态氢化物稳定 |
将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是
| A.稀硝酸 | B.稀盐酸 | C.硝酸铜 | D.氢氧化钠 |
下列表示对应化学反应的离子方程式正确的是
A.电解饱和NaCl溶液:2Cl-+2H+  H2↑+Cl2↑ H2↑+Cl2↑ |
B.向Na2SO3溶液中滴加足量NaClO溶液: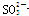 + ClO-= + ClO-=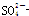 + Cl- + Cl- |
| C.向FeBr2溶液中通入足量Cl2:2Fe2++Cl2=2Fe3++2Cl- |
D.向Ca(OH)2溶液中加少量NaHCO3溶液: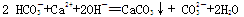 |
工业废气中的氮氧化物(如NO、NO2等,用通式NOx表示)是主要的大气污染物之一.为了保护环境,工业上常通入氨气与之发生如下反应:NOx+NH3―→N2+H2O来消除污染.有关此反应,下列说法中错误的是
| A.N2既是氧化产物又是还原产物 |
| B.当x=1时,每生成2.5 mol N2,被氧化的气体有3 mol |
| C.当x=2时,有1 mol气体被还原,转移电子4 mol |
| D.反应通式配平表示为:6NOx+4xNH3===(3+2x)N2+6xH2O |