瑞士化学家米勒因合成DDT于1948年获得诺贝尔医学奖。在第二次世界大战中的1944年,美国在意大利的许多士兵因使用DDT来扑灭传染斑疹伤寒流行病人身上的虱子而避免丧生。联合国世界卫生组织曾评价说:“单独从疟疾病者,DDT可能拯救了5000万生命。”但进一步的观察和研究表明,DDT是一种难降解的有毒化合物,进入人体内可引起慢性中毒。我国已于1983年停止生产和使用。
(1)杀虫剂“1605”本身对人畜毒性远强于DDT,但DDT已被禁用,而“1605”尚未禁用,这是因为________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
由结构分析知:“1605”在使用过程中,不能与________物质混合使用,否则会因________________________________________________________________________。
(2)DDT可以用电石为原料经以下途径而制得: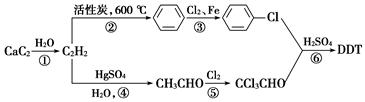
①写出④⑤⑥步反应的化学方程式。
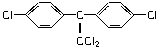
②DDT有毒性,国际上已禁止使用,因为它在动物体内转化为一种使动物生长失调的物质(结构如下面所示结构式)。在实验室也可实现这种转化,表示这种转化的化学方程式为________________________________________________________________________
________________________________________________________________________。
固体硝酸盐加热易分解且产物较复杂。已知KNO3、Cu(NO3)2、AgNO3三种硝酸盐的热分解反应方程式如下:
I.2KNO3 2KNO2+O2↑
2KNO2+O2↑
II.2Cu(NO3) 2 2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑
III.2AgNO3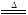 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑
(1)某固体可能由KNO3、Cu(NO3)2、AgNO3三种硝酸盐中的一种或几种组成。取适量该固体充分加热,得到一定量气体。若该气体经水充分吸收后,剩余气体的体积在同温同压下为吸收前的1/6。 (忽略氧在水中的溶解)
①若该固体只是由一种盐组成,则该盐为。
②若该固体是混合物,则该混合物的可能组成为。
(2)某学习小组以Mg(NO3)2为研究对象,通过实验探究其热分解的产物,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):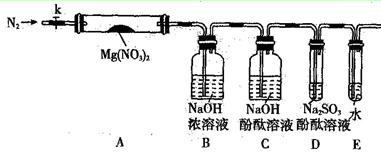
【实验步骤】
a.仪器连接后,放入固体试剂之前,关闭k,微热硬质玻璃管A。
b.称取Mg(NO3)2固体3.7g置于A中,先通入一段时间N2,再关闭k,用酒精灯加热硬质玻璃管A。
c.待样品完全分解,A 装置冷却至室温、称量,测得剩余固体的质量为1.0g。
①步骤a的目的是;
②依据已知的三个方程式,再根据剩余固体的质量写出Mg(NO3)2热分解方程式为:。
③若A中固体为AgNO3,用以上实验装置进行实验时,D 中的现象为,用离子方程式表示出现该现象的原因:_____________________。
④从实验安全的角度判断该实验装置有无缺陷?若有,应如何改进?。
X、Y、Z、W是元素周期表中前30号元素,且原子序数依次增大。其相关信息如下表:
| 元素 |
相关信息 |
| X |
X原子基态时最外层电子数是其内层电子总数的2倍 |
| Y |
Y的基态原子最外层电子排布式为nsnnpn+2 |
| Z |
Z元素的最高正价与负价代数和为6 |
| W |
W基态原子未成对电子数是前30号元素中最多的 |
(1)W位于元素周期表第周期第族,其基态原子最外层有个电子。
(2)X的第一电离能比Y的(填“大”或“小”),1mol X22-中含有的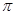 键数目为。
键数目为。
(3)X和Y的气态氢化物中,较稳定的是(写化学式),Y的同族元素(包括Y)的最简单氢化物中沸点最低的是。
(4)写出KZY3与HZ浓溶液反应制取Z2的化学方程式,并标出电子转移的方向和数目。
(5)已知:X(s)+Y2(g)=XY2(g) ΔH 1= -393.5 kJ•mol-1
XY(g) +1/2Y2(g)=XY2(g) ΔH 2= -282.9 kJ•mol-1
则X(s)与Y2(g)反应生成XY(g)的热化学反应方程式为。
下图是中学化学中常见物质的转化关系,部分物质和反应条件略去。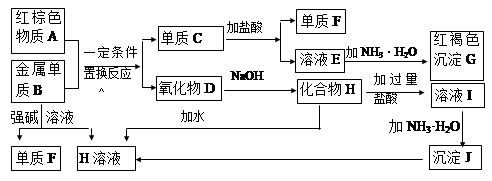
(1)G加热可分解生成A,A的化学式为________,写出物质A的一种用途。
(2)写出单质B与强碱溶液反应的离子方程式_______________________________________,写出由沉淀J生成 H溶液的离子方程式___________________________________________.。
(3)溶液E中加入氨水时,先生成白色沉淀L,写出生成L的离子方程式_______________________,白色沉淀L会迅速变为色,最终变为红褐色沉淀G,写出L变为G的化学反应方程式。
(4)溶液I中所含金属离子是_____________________。
有一瓶无色澄清的溶液,其中可能含NH4+、K+、Na+、Mg2+、H+、Cu2+、CO32-、I-中的一种或几种,取该溶液进行如下实验:
①用PH试纸检验,表明溶液呈强酸性
②取部分溶液,加入少量的CCl4及数滴新制的氯水,振荡后CCl4层显紫红色
③另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成
④将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定并回答:
(1)在溶液中,肯定存在的有___________,肯定不存在的离子有__________________。
(2)写出实验④中的离子反应方程式,
(3)不能确定是否存在的离子有__________________________。请设计简单实验方案证明它(们)是否存在(写出实验方法、现象、结论)__________ _________。
(1)向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中轻缓地加入一粒绿
豆大小的金属钠,观察到的现象正确的是________________。
A B C D
(2)金属钠失火时,应该用灭火。
(3)过氧化钠可用作潜水艇的供养剂,主要化学反应方程式为。
(4)实验室盛放氢氧化钠溶液的试剂瓶不用玻璃塞,是因为玻璃中含(填化学式),刻蚀玻璃常用的试剂是氢氟酸,发生反应的化学方程式为。
(5)制取水泥和陶瓷的共同原料是。