B、D是常见金属单质,A是一种红棕色金属氧化物,电解熔融态的C得到B单质,J是一种难溶于水的白色固体。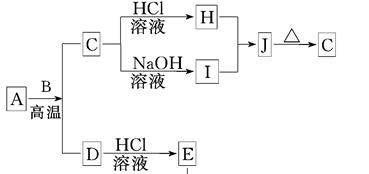
(1)在E的溶液中加入氢氧化钠溶液,可以观察到的现象是________________________.
(2)按要求写化学方程式或离子方程式:
①A与B在高温条件下生成C和D的化学方程式:____________________________;
②在E的水溶液中通入氯气后的生成物和I溶液反应的离子方程式: 。
(3)由D和A组成的混合物与稀HCl作用,固体恰好溶解,所得溶液中滴加KSCN溶液不显红色,且生成的E与H2的物质的量之比为4:1。则反应物中A、D、HCl的物质的量之比为____。
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下图的反应(图中有些反应的产物和反应的条件没有全部标出)。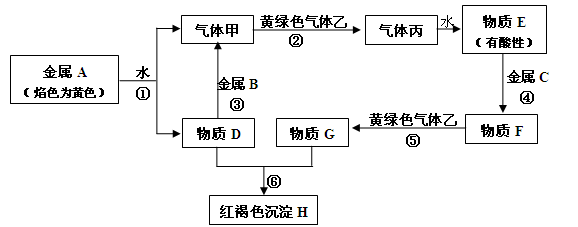
请根据以上信息回答下列问题:
(1)写出下列物质化学式:B、F、H、乙。
(2)写出下列反应的化学方程式
反应①。
反应③。
(3)检验物质G中阳离子的方法。
现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。A元素的价电子构型为nsnnpn+1;C元素为最活泼的非金属元素,D元素核外有三个电子层,最外层电子数是核外电子总数的1/6;E元素正三价离子的3d轨道为半充满状态,F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)A元素的第一电离能B元素的第一电离能(填“<”“>”或“=”),A、B、C三种元素电负性由小到大的顺序为(用元素符号表示)。
(2)D元素原子的价电子排布式是。
(3)C元素的电子排布图为;E3+的离子符号为。
(4)F元素位于元素周期表的区,其基态原子的电子排布式为。
(5)G元素可能的性质。
A.其单质可作为半导体材料
B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸
已知0.1mol有机物A的质量是12g,在足量的氧气中充分燃烧后生成35.2g CO2和7.2g H2O; A可以发生银镜反应,其苯环上的一溴代物有三种。
(1)A的分子式为____________。
(2)A发生银镜反应的化学方程式为。
已知: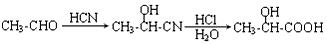
现有如下转化关系: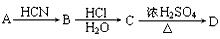
其中D能使溴的四氯化碳溶液褪色。
(3)写出下列反应的化学方程式(有机物用结构简式表示):
①C转化为D的反应;
②一定条件下,D生成高分子化合物的反应。
(4)C的同分异构体有多种,其中符合下列要求的有机物有种(不考虑立体异构)。
①与C具有相同的官能团种类
②遇三氯化铁溶液不显色
③苯环上的一氯代物只有两种
化合物H(C13H16O2)是一种香料,存在于金橘中,以烷烃A为原料合成H的路线如下: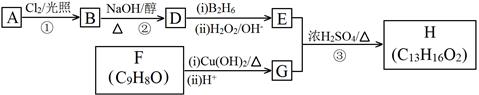
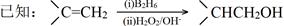
请回答:
(1)②的反应类型是;H中的官能团名称是。
(2)F属于芳香族化合物,它的分子具有反式结构,则F的结构为。
(3)B是A的一卤代物,经测定B分子中有3种不同化学环境的氢,则A的名称(系统命名)是。
(4)D发生加聚反应的化学方程式为:。
(5)③的化学方程式是。
(6)芳香族化合物I是G的同分异构体,与G具有相同的官能团,则I的结构可能有种(不包括顺反异构);其中苯环上的一氯代物有2种的I的结构简式是。
已知:

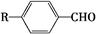 ,为合成某种液晶材料的中间体M,有人提出如下不同的合成途径:
,为合成某种液晶材料的中间体M,有人提出如下不同的合成途径:
(1)A的分子式为__________,1molA完全燃烧需要消耗________mol O2。
(2)常温下,下列物质能与A发生反应的有(双选)。
| A.苯 | B.Br2/CCl4 | C.乙酸乙酯 | D.KMnO4/H+溶液 |
(3)由C→B的反应类型为。
(4)由A催化加氢生成M的过程中,可能有中间生成物 和___________(写结构简式)生成。
和___________(写结构简式)生成。
(5)检验B中是否含有C可选用的试剂是(任写一种名称)。
(6)物质B也可由C10H13Cl与NaOH水溶液共热生成,C10H13Cl的结构简式为。