一定条件下,将一定量的A、B、C、D四种物质,置于密闭容器中发生如下反应:
m A(s)+n B(g) p C(g)+q D(g) △H
p C(g)+q D(g) △H
达到平衡后,测得B的浓度为0.5 mol/L。保持温度不变,将密闭容器的容积扩大到原来的两倍,再次达到平衡后,测得B的浓度为0.3mol·L-1。当其它条件不变时,C在反应混合物中的体积分数(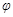 )与温度(T)、时间(t)的关系如下图所示。下列叙述正确的是( )
)与温度(T)、时间(t)的关系如下图所示。下列叙述正确的是( )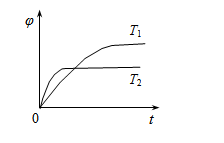
A.热化学方程式中:n<p+q
B.热化学方程式中:△H>0
C.达平衡后,增加A的量,有利于提高B的转化率
D.若T1、T2时反应的平衡常数分别为K1、K2,则K1>K2
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表: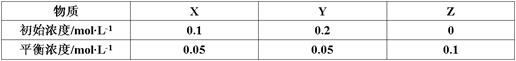
下列说法错误的是
| A.反应达到平衡时,X的转化率为50% |
B.反应可表示为X+3Y 2Z,其平衡常数为1600 2Z,其平衡常数为1600 |
| C.增大压强使平衡向生成Z的方向移动,平衡常数增大 |
| D.改变温度可以改变此反应的平衡常数 |
25 ℃时,浓度均为为0.1 mol/L的HA溶液和BOH溶液,pH分别是1和11,下列说法正确的
A.BOH溶于水,其电离方程式是BOH B+ + OH- B+ + OH- |
| B.若将一定量的上述溶液混合后pH = 7,则c(A-)= c(B+) |
| C.在0.1 mol/L BA溶液中,c(B+)> c(A-)> c(OH-)> c(H+) |
| D.若将0.1 mol/L BOH溶液稀释至0.001 mol/L,则溶液的pH = 9 |
下图表示反应N2(g)+3H2(g) 2NH3(g) △H<0,在某一时间段中反应速率与反应过程的曲线关系图。下列说法正确的是
2NH3(g) △H<0,在某一时间段中反应速率与反应过程的曲线关系图。下列说法正确的是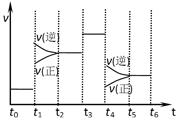
| A.氨气的体积分数最高的一段时间为t5~t6 |
| B.t2~t3和t3~t4时间段氨气的体积分数相等 |
| C.t1时刻改变的条件是降低温度 |
| D.t4~t5时间段平衡向正反应方向移动 |
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH
溶液,其充、放电过程按下式进行:Cd + 2NiOOH + 2H2O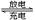 Cd(OH)2 + 2Ni(OH)2,
Cd(OH)2 + 2Ni(OH)2,
有关该电池的说法正确的是
| A.充电时阳极反应:Ni(OH)2-e—+ OH—="=" NiOOH + H2O |
| B.充电过程中镉元素被氧化 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH—向正极移动 |
常温下,某无色溶液能与铝反应放出氢气,该溶液中一定能大量存在的离子组是
| A.Na+、K+、MnO4-、SO42- | B.Mg2+、NH4+、SO42-、Cl- |
| C.Na+、Cl-、K+、SO42- | D.Na+、K+、CO32-、NO3- |