已知可逆反应CO + H2O (g) CO2 + H2,在830K温度下达到平衡。
CO2 + H2,在830K温度下达到平衡。
(1)其化学平衡常数K的表达式为K= 。
(2)830K时,若起始时:c (CO) = 2 mol/L,c (H2O) = 3 mol/L,平衡时CO的转化率为60%,水蒸气的转化率为______________;K值为______________。
(3)830K,若只将起始时c (H2O)改为6 mol/L,则水蒸气的转化率为____________。
(4)若830K时,起始浓度c (CO)=a mol/L,c (H2O)=b mol/L,H2的平衡浓度c (H2)=c mol/L,
①a、b、c之间的关系式是____________________________________;
②当a = b时,a= ________c。
结构决定性质,性质体现结构。对结构和性质的研究是学好化学的基础。
(1)下列4种物质熔点沸点由高到低排列为______________(填序号)
①金刚石(C—C) ②晶体硅(Si—Si) ③金刚砂(Si—C)
(2)某晶体的晶胞如图所示,X位于体心,Y位于4个面心,Z位于8个
顶点,该晶体中 X、Y、Z的粒子个数比为______________;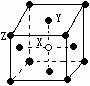
(3)按所示格式填写下表有序号的表格:
| 原子序数 |
原子价层电子排布 |
周期 |
族 |
| 17 |
① |
第三 |
② |
| ③ |
3d54s1 |
④ |
ⅥB |
(4)某元素的激发态原子的电子排布式为1s 2s
2s 2p
2p 3s
3s 3p
3p 4s
4s ,则该元素基态原子的电子排布式为 ;其最高价氧化物对应的水化物的化学式是。
,则该元素基态原子的电子排布式为 ;其最高价氧化物对应的水化物的化学式是。
(12分)一定温度下,向如图所示带有可移动活塞的密闭容器中充入2 L SO2和1 L O2的混合 气体,发生如
气体,发生如 下反应2 SO2 (g) + O2 (g)
下反应2 SO2 (g) + O2 (g) 
 2 SO3 (g) 。
2 SO3 (g) 。
(1) 若活塞可自由移动,平衡后,活塞停止在“2.1”处该反应中SO2的转化率为。
(2) 若开始时,充入容器的起始物质分别是
①2 L SO2和1 L O2;
②2 L SO3 (g) 和 1 L N2 ;
③1 L SO2、1 L O2和 1 L SO3 (g),
使活塞固定在“3”处,达到平衡后,容器中SO3 (g)占反应混合物的体积分数的大小关系是:(用序号①②③和“<”、“=”、“>”表示)。
(3) 向(1)平衡后的容器中充入0.2 mol 的SO3,活塞移动后再次达到平衡时,测得此过程中从外界共吸收了1.96 kJ 的热量。写出SO2发生氧化反应的热化学方程式:
_______________。
(9分) 如图所示,一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g) + 2H2(g)  CH3OH(g)
CH3OH(g)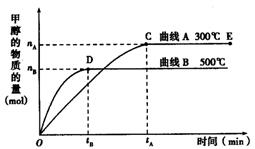
上述可逆反应正反应为___________反应(填“放热”或“吸热”)。
在500℃,从反应开始到平衡,氢气的平均反应速率v(H2) =___________________________(用nB、tB表示)。
对处于E点的体系,改变外界条件使平衡向正反应方向移动时,下列有关该体系的说法正确的是______________________(填字母)。
| A.H2的转化率一定增大 | B.v正一定增大,v逆一定减小 |
| C.CH3OH的质量分数一定增加 | D.v逆一定小于v正 |
CH3OH(g)+H2O(g) CO2(g)+3H2(g);该反应的正反应为吸热反应,请根据题目要求回答下列问题:
CO2(g)+3H2(g);该反应的正反应为吸热反应,请根据题目要求回答下列问题:
(1)在其它条件不变的情况下降低温度,则逆反应速率 (填“增大”或“减小”或“不变”,下同);在其它条件不变的情况下加压,则正反应速率 。
(2)一定条件下,向体积为2L的密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为。
(3)判断该可逆反应达到平衡状态的依据是(填序号)。
| A.v正(CH3OH)=v正(CO2) |
| B.混合气体的密度不变 |
| C.混合气体的平均相对分子质量不变 |
| D.CH3OH、H2O、CO2、H2的浓度都不再发生变化 |
已知25℃、101kpa时,一些物质的燃烧热为:
| 化学式 |
CO(g) |
H2(g) |
CH3OH(l) |
CH4(g) |
| △H/(kJ/mol) |
-283.0 |
-285.8 |
-726.5 |
-890.3 |
请回答下列问题。
(1)写出该条件下CH3OH(l)完全燃烧的热化学方程式:。
(2)根据盖斯定律完成下列反应的热化学方程式:CO(g)+ 2H2(g)= CH3OH(l);△H=。
(3)现有H2和CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2(g)和H2O(l),共放出热量3242.5 kJ,则原混合气体中H2和CH4的物质的量之比是:
| A.1∶1 | B.1∶3 | C.1∶4 | D.2∶3 |