能够鉴别醋酸溶液、葡萄糖溶液、蔗糖溶液的试剂是( )
| A.稀盐酸 | B.Cu(OH)2悬浊液 |
| C.NaOH溶液 | D.Na2CO3溶液 |
若元素X位于ⅠA族,Y为短周期元素,X与Y可形成化合物X2Y,下列说法正确的是
| A.X的原子半径一定大于Y的原子半径 |
| B.X与Y的简单离子不可能具有相同的电子层结构 |
| C.两元素形成的化合物中,原子个数比不可能为1:1 |
| D.X2Y可能是离子化合物,也可能是共价化合物 |
已知某离子的结构示意图为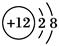 ,下列说法正确的是
,下列说法正确的是
| A.该元素位于第二周期第ⅡA族 |
| B.该元素位于第二周期第Ⅷ族 |
| C.该元素位于第三周期第ⅡA族 |
| D.该元素位于第三周期0族 |
下列关于指定粒子构成的几种描述中不正确的是
| A.37Cl与39K具有相同的中子数 |
B.第114号元素的一种核素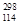 X与82Pb具有相同的最外层电子数 X与82Pb具有相同的最外层电子数 |
| C.H3O+与OH-具有相同的质子数和电子数 |
D.O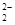 和S2-具有相同的质子数和电子数 和S2-具有相同的质子数和电子数 |
下列元素中,最高正化合价数值最大的是
| A.Na | B.P | C.C1 | D.C |
下列关于自然界中氮循环(如图)的说法不正确的是
| A.氮元素均被氧化 |
| B.工业合成氨属于人工固氮 |
| C.含氮无机物和含氮有机物可相互转化 |
| D.碳、氢、氧三种元素也参与了氮循环 |