下列叙述不正确的是( )
A.NH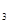 易液化,氨常用作制冷制 易液化,氨常用作制冷制 |
B.与金属反应时,稀HNO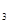 可能被还原为更低价态,则稀HNO 可能被还原为更低价态,则稀HNO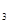 氧化性强于浓HNO 氧化性强于浓HNO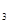 |
| C.铵盐受热易分解,因此贮存氨态氮肥时要密封保存,并放在阴凉通风处 |
| D.常温下可以用铁、铝制容器盛装浓硫酸或浓硝酸 |
下列有关设计的方案能达到实验目的的是
| A.制备Fe(OH)3胶体:向0.1mol·L-1FeCl3溶液中加入等体积0.3mol·L-1NaOH溶液 |
| B.除去FeCl3溶液中少量Cu2+:向含有少量Cu2+的FeCl3溶液中加入适量铁粉,充分反应后过滤 |
| C.比较Fe(OH)3和Al(OH)3的溶度积:向0.1mol·L-1FeCl3溶液中滴加0.1 mol·L-1 氨水至不再产生沉淀,然后再滴入0.1mol·L-1AlCl3溶液,观察现象 |
| D.验证氧化性Fe3+<Br2<Cl2:向试管中依次加入1mL 0.1mol·L-1FeBr2溶液、几滴KSCN溶液和1mL苯,然后逐滴加入氯水,并缓缓振荡,直到氯水过量,观察整个过程中有机相和水相中的现象 |
下列图示箭头方向表示与某种常见试剂在通常条件下(不含电解)发生转化,其中6步转化均能一步实现的一组物质是
| 选项 |
W |
X |
Y |
Z |
 |
| A |
N2 |
NH3 |
NO |
NO2 |
|
| B |
Na |
Na2O2 |
NaOH |
Na2CO3 |
|
| C |
Cu |
CuSO4 |
CuCl2 |
Cu(OH)2 |
|
| D |
Al |
Al2(SO4)3 |
AlCl3 |
NaAlO2 |
2015年诺贝尔生理学或医学奖的一半授予我国药物化学家屠吆吆,以表彰她发明抗疟疾新药青蒿素和双氢青蒿素。以异胡薄荷醇为起始原料是人工全合成青蒿素的途径之一(如右图)。下列说法正确的是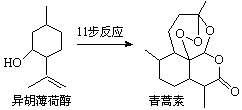
| A.异胡薄荷醇的分子式为C10H17O |
| B.异胡薄荷醇在NaOH醇溶液中可发生消去反应 |
| C.青蒿素分子中含有7个手性碳原子 |
| D.青蒿素在热的酸、碱溶液中均可稳定存在 |
下列有关氯气及其含氯分散系的说法正确的是
| A.钢铁在Cl2气氛中主要发生电化腐蚀 |
| B.在新制氯水中加入少量CaCO3,溶液中c(HClO)增大 |
| C.反应3Cl2(g) + 8NH3(g) = 6NH4Cl(s) + N2(g)的△H>0,△S<0 |
D.0.1mol·L-1NaClO溶液中:c(HClO) + c(H+) = c(OH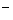 ) ) |
H2S废气资源化利用途径之一是回收能量并得到单质硫。反应原理为:2H2S(g) + O2(g) = S2(s) + 2H2O(l) △H=-632kJ·mol-1。右图为质子膜H2S燃料电池的示意图。下列说法正确的是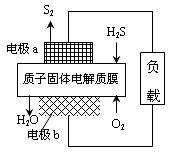
| A.电极a为电池的正极 |
B.电极b上发生的电极反应为:O2+2H2O+4e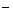 =" 4" OH =" 4" OH |
| C.电路中每流过4mol电子,电池内部释放632kJ热能 |
| D.每17gH2S参与反应,有1mol H+经质子膜进入正极区 |