从植物花朵中提取到一种色素,它实际上是一种有机弱酸,可用HR表示,HR在盐酸溶液中呈现红色,HR在NaOH溶液中呈现蓝色,将HR加入浓硝酸中呈现红色,微热后溶液的红色褪去,根据以上现象,可推测( )
| A.HR应为红色 | B.HR应为蓝色 |
| C.R-应为无色 | D.R- 应为红色 |
甲、乙、丙、丁四种物质,甲、乙、丙含同一种元素。下列各组物质可按下图转化的是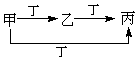
| ① |
② |
③ |
④ |
|
| 甲 |
CH4 |
S |
AlCl3 |
Fe |
| 丙 |
CO2 |
SO3 |
NaAlO2 |
FeCl3 |
A.①② B.②③ C.①③ D.③④
用下列实验装置和方法进行相应实验,能达到实验目的的是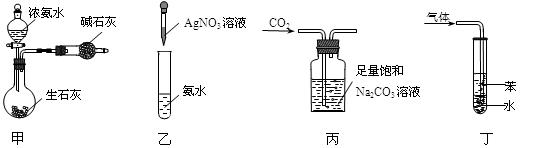
| A.用图甲装置制取干燥的氨气 |
| B.用图乙装置配制银氨溶液 |
| C.用图丙装置除去CO2中含有的少量HCl |
| D.用图丁装置吸收NH3,并防止倒吸 |
下列有关物质性质的应用正确的是
| A.H2O2有还原性,可用于漂白织物和杀菌消毒 |
| B.MgO的熔点很高,可用于制造耐火材料 |
| C.75%医用酒精能使蛋白质溶液发生盐析,可用于杀菌消毒 |
| D.常温下,铝遇浓硝酸会钝化,可用铝槽车运输浓硝酸和稀硝酸 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.使石蕊变红色的溶液:NH4+、Cu2+、HCO3-、Cl- |
| B.常温下,c(H+)/c(OH一)=1×10-14的溶液:K+、Na+、AlO2-、CO32- |
| C.0.1 mol·L-1的KI溶液: Na+、H+、NO3-、SO42- |
| D.遇苯酚变紫色的溶液:Na+、Mg2+、SCN-、Cl- |
下列有关化学用语表示正确的是
A.水的电子式: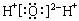 |
B.中子数为145、质子数为94的钚(Pu)原子: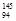 Pu Pu |
C.甲烷分子的比例模型: |
D.HCO3-的电离方程式:HCO3-+H2O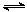 H2CO3+H3O+ H2CO3+H3O+ |