室温下,在由水电离出的c(H+)=1×10-13mol/L的溶液中一定能大量共存的离子组是
| A.Fe2+、Na+、NO3-、Cl- | B.Ba2+、Na+、NO3-、Cl- |
| C.SO42-、HCO3-、NH4+、Na+ | D.Mg2+、Na+、Br-、AlO2- |
已知反应4NH3+5O2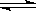 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列正确的关系是( )
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列正确的关系是( )
A.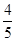 v(NH3)=v(O2) v(NH3)=v(O2) |
B. v(O2)=v(H2O) v(O2)=v(H2O) |
C.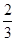 v(NH3)=v(H2O) v(NH3)=v(H2O) |
D.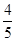 v(O2)=v(NO) v(O2)=v(NO) |
化学平衡常数可以用K来表示,下列关于化学平衡常数的说法中正确的是( )。
| A.K越大,反应物的转化率越小 |
| B.K与反应物的浓度有关 |
| C.K与生成物的浓度有关 |
| D.K与温度有关 |
反应A(g)+B(g) C(g)+D(g)过程中的能量变化如图所示,下列说法正确的是(双选)( )。
C(g)+D(g)过程中的能量变化如图所示,下列说法正确的是(双选)( )。
| A.该反应是放热反应 |
| B.加入催化剂后,反应加快,ΔE减小 |
| C.反应物的总键能大于生成物的总键能 |
| D.反应达到平衡时,升高温度,A的转化率增大 |
下列依据热化学方程式得出的结论正确的是(双选)( )。
| A.已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1 |
| B.已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量 |
| C.已知2C(s)+2O2(g)===2CO2(g) ΔH=a;2C(s)+O2(g)===2CO(g) ΔH=b,则a>b |
| D.已知C(石墨,s)===C(金刚石,s) ΔH>0,则石墨比金刚石稳定 |
已知:①1 mol H2分子中化学键断裂时需要吸收436 kJ的能量 ②1 mol Cl2分子中化学键断裂时需要吸收243 kJ的能量 ③由H原子和Cl原子形成1 mol HCl分子时释放431 kJ的能量。下列叙述正确的是 ( )。
| A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)===2HCl(g) |
| B.氢气和氯气反应生成2 mol氯化氢气体,反应的ΔH=+183 kJ·mol-1 |
| C.氢气和氯气反应生成2 mol氯化氢气体,反应的ΔH=-183 kJ·mol-1 |
| D.氢气和氯气反应生成1 mol氯化氢气体,反应的ΔH=+183 kJ·mol-1 |