浓度均为0.1 mol·L-1的下列溶液,其pH由小到大的排列顺序是
①Na2CO3溶液 ②NaHSO4溶液 ③NaCl溶液 ④AlCl3溶液
| A.①<②<③<④ | B.①<③<④<② |
| C.②<④<③<① | D.④<③<②<① |
对于可逆反应,2SO2 (g)+ O2(g) 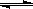 2SO3(g) DH <0在一定温度下其平衡数为K,下列说法正确的是
2SO3(g) DH <0在一定温度下其平衡数为K,下列说法正确的是
| A.增大SO2的转化率K值一定增大 | B.减小压强K值减小 |
| C.K值越大SO2转化率越大 | D.升高温度K值增大 |
在密闭容器中一定量混合气体发生反应:x A (g) + y B(g) ≒ z C(g),平衡时测得A的浓度为 0.5 mol/L,保持温度不变,将容器的 容积扩大到原来的2倍,再达平衡时测得A的浓度为 0.2mol/L,下列判断正确的是
容积扩大到原来的2倍,再达平衡时测得A的浓度为 0.2mol/L,下列判断正确的是
| A.x+y >z | B.平衡向正反应方向移动 |
| C.B的转化率降低 | D.C的体积分数保持不变 |
一定温度下的反应A(g)+3B(g)≒2C(g),下列叙述不能表明它达到化学平衡的是
A.A、B、C的浓度不再变化
B.混合气体的总物质的量不再变化
C.单位时间内a mol A生成,同时生成3amol B
D.C的生成速率与C的分解速率相等
在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH≒CH3COO-+H+对于该平衡,下列叙述正确的是
| A.加入水时,平衡向电离方向移动,pH减小 |
| B.加入少量NaOH固体,平衡向电离方向移动 |
| C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小[ |
| D.加入少量CH3COONa固体,平衡向电离方向移动 |
下列不能用勒沙特列原理解释的是
| A.Fe(SCN)3溶液中加入固体KSCN后颜色变深 |
| B.棕红色NO2加压后颜色先变深后变浅 |
| C.SO2催化氧化成SO3的反应,往往需要使用催化剂 |
| D.H2、I2、HI平衡混和气加压后颜色变深 |