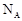 表示阿伏加德罗常数的值。下列说法正确的是 ( )
表示阿伏加德罗常数的值。下列说法正确的是 ( )
A.标准状况下,铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为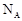 |
| B.标准状况下,22.4L SO3与水反应生成1mol硫酸 |
C.足量铜与1L 18 mol/L浓硫酸反应可以得到SO2的分子总数为9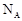 |
D.标准状况下,22. 4L任意比的氢气与氧气的混合气体中含有的分子总数均为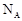 |
下列物质中既能跟稀硫酸反应,又能跟氢氧化钠溶液反应的是
① NaHCO3②Al2O3 ③Al(OH)3 ④ Al ⑤ Na2CO3
| A.①③④ | B.②③④⑤ | C.①②③④ | D.全部 |
下列关于铁的叙述正确的是
①铁能被磁铁吸引,但纯铁比含杂质的铁易被腐蚀
②在人体的血红蛋白中含有铁元素
③铁能在氧气中剧烈燃烧,但不能在水蒸气中燃烧
④铁与强氧化剂硝酸反应的产物只有一种是Fe(NO3)3
⑤不能通过化合反应制得FeCl2和Fe(OH)3
| A.①③ | B.②③ | C.②⑤ | D.④⑤ |
市场上销售的“84”消毒液,其商品标识上有如下叙述:①本品为无色液体,呈碱性②使用时加水稀释③可对餐具、衣物进行消毒,可漂白浅色衣物。其有效成分可能是
| A.Cl2 | B.SO2 | C.NaClO | D.KMn04 |
类比归纳是学习化学的重要方法,以下类比的说法正确的是
| A.CO2、SO2都是酸性氧化物,都能使酸性高锰酸钾溶液褪色 |
| B.MgO、Al2O3都是高熔点离子化合物,熔化时都能导电 |
| C.CO2与SiO2化学式相似,则CO2与SiO2的物理性质也相似 |
| D.CuO、Fe2O3都是不溶于水的碱性氧化物,都是黑色粉末 |
将氯水分别滴入下列各选项所述的溶液中,由实验现象得出的结论完全正确的是
| 选项 |
氯水滴入下列溶液中 |
实验现象 |
结论 |
| A |
滴有KSCN的FeCl2溶液 |
变血红 |
Cl2具有还原性 |
| B |
滴有酚酞的NaOH溶液 |
褪色 |
Cl2具有漂白性 |
| C |
紫色石蕊溶液 |
先变红后褪色 |
Cl2具有酸性、漂白性 |
| D |
KI淀粉溶液 |
变蓝色 |
Cl2具有氧化性 |