已知反应:①101 kPa时,2H2(g)+O2(g)===2H2O(g);ΔH=-483.6 kJ/mol
②稀溶液中,H+(aq)+OH-(aq)===H2O(l);
ΔH=-57.3 kJ/mol
又知由H2和O2反应生成1 mol液态水比生成1 mol气态水多放出44 kJ热量.下列结论中正确的是( )
| A.H2的燃烧热为285.8 kJ/mol |
B.H2和O2反应生成液态水时的热化学方程式为H2(g)+ O2(g)===H2O(l); O2(g)===H2O(l);ΔH=-571.6 kJ/mol |
| C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ |
| D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
某学生根据反应2HCl+2Ag === 2AgCl+H2↑的原理,设计了下图所示的四个装置,你认为合理的是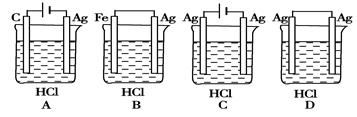
某小组为了研究电化学原理设计了如图所示的装置,下列说法中错误的是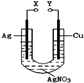
| A.X和Y不连接时,铜棒上会有金属银析出 |
| B.X和Y用导线连接时,银棒是正极,发生氧化反应 |
| C.若X接直流电源的正极,Y接负极,Ag+向铜电极移动 |
| D.无论X和Y是否用导线连接,铜棒均会溶解,溶液都从无色逐渐变成蓝色 |
在10 L密闭容器中,1 mol A和3 mol B在一定条件下反应:A(g)+xB(g)  2C(g),
2C(g),
2 min后达到平衡,生成0.4 mol C,测得混合气体共3.4 mol,则下列结果正确的是
A.平衡时,物质的量之比n(A)∶n(B)∶n(C)=2∶11∶4
B.x值等于3
C.A的转化率为20%
D.B的平均反应速率为0.4 mol/(L·min)
在恒容密闭容器中发生反应2NO2  2NO+O2,下列所述可以说明反应达到平衡状态的是
2NO+O2,下列所述可以说明反应达到平衡状态的是
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2的同时生成2n molNO
③混合气体的颜色不再改变
④混合气体的密度不再改变
| A.①③ | B.②④ | C.①③④ | D.①②③④ |
下图所示为800 ℃ 时A、B、C三种气体在密闭容器中反应时浓度的变化,只分析图形不能得出的结论是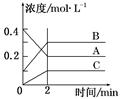
A.A是反应物
B.前2 min A的分解速率为0.1 mol·L-1·min-1
C.达平衡后,若升高温度,平衡向正反应方向移动
D.反应的方程式为:2A(g)  2B(g) +C(g)
2B(g) +C(g)