下列热化学方程式中,△H能正确表示物质的燃烧热或中和热的是
| A.2H2(g) + O2(g) ==2H2O(l)ΔH==-572kJ·mol—1 |
| B.KOH(aq)+ CH3COOH (aq) =CH3COOK (aq)+H2O(l);△H=-57.3 kJ·mol–1 |
| C.C8H18(l)+ 12.5O2 (g) = 8CO2 (g)+ 9H2O(l);△H=-5518 kJ·mol–1 |
| D.CH4(g) + 2O2(g) ==CO2(g) + 2H2O(g)ΔH==-533kJ·mol—1 |
接触法生产H2SO4的过程中,对废气、废液、废渣和“废热”的处理正确的是
①尾气用氨水处理②污水用石灰乳处理
③废渣用来炼铁、制水泥等④将“废热”通过“废热”锅炉产生蒸气发电
| A.只有①② | B.只有①③④ | C.只有①②③ | D.全部 |
在下列条件下,各离子组一定能大量共存的是
A.强碱性溶液中:K+、Al3+、Cl-、SO42- |
B.室温下,pH=0的溶液中: Na+、Fe3+、NO3-、SO42- |
C.含有1 mol·L-1 Fe3+的溶液中:K+、Mg2+、I-、NO3- |
D.由水电离的c(H+)=1×10-14的溶液中:K+、C a2+、Cl-、HCO3- a2+、Cl-、HCO3- |
已知25%的氨水的密度为0.91 g/cm3,5%的氨水的密度为0.98 g/cm3.若将上述两溶液等体积混合,所得氨水的质量分数是
| A.等于于15% | B.大于15% |
| C.小于15% | D.无法确定 |
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O +O2+xOH—
+O2+xOH—Fe3O4+S4O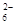 +2H2O下列说法中,正确的是
+2H2O下列说法中,正确的是
| A.每生成1mol Fe3O4,反应转移的电子总数为3mol |
B.Fe2+和S2O 都是还原剂 都是还原剂 |
| C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol |
| D.x=6 |
下列现象或事实可用同一原理加以解释和说明的是
| A.氯化铵和碘都可以用加热法进行提纯 |
| B.浓硫酸和浓盐酸长期暴露在空气中浓度降低 |
| C.硫酸亚铁溶液和氢氧化钠溶液在空气中久置后均会变质 |
| D.二氧化硫气体均能使高锰酸钾溶液和溴水褪色 |