用标准的盐酸滴定未知浓度的NaOH溶液,下列各操作中,不会引起实验误差的是
| A.用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定 |
| B.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,而后装入一定体积NaOH溶液进行滴定 |
| C.用碱式滴定管取10.00 mL NaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水进行滴定 |
| D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液 |
下图是水煤气(成分为CO、H2)空气燃料电池的工作原理示意图,a、b均为惰性电极。下列叙述中正确的是()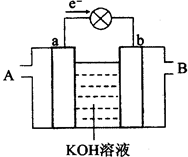
| A.A处通入空气,B处通入水煤气 |
| B.a电极的反应式包括:CO+4OH--2e-=CO32-+2H2O |
| C.a电极发生还原反应,b电极发生氧化反应 |
| D.如用这种电池电镀铜,当镀件增重6.4g,则消耗标准状况下的水煤气2.24 L |
pH为2的盐酸和pH为11的NaOH溶液恰好完全反应时,二者的体积比为()
| A.1:10 | B.10:1 | C.1:1 | D.1:100 |
汽车的启动电源常用铅蓄电池,放电时的电池反应如下:Pb+ PbO2 + 2H2SO4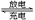 2PbSO4 + 2H2O根据此反应判断下列叙述中正确的是()
2PbSO4 + 2H2O根据此反应判断下列叙述中正确的是()
| A.放电时PbO2是电池的负极 |
| B.放电时,负极的电极反应式为:Pb+SO42--2e-=PbSO4 |
| C.放电时,溶液中的H+向正极区移动,正极区域的溶液的酸性增强 |
| D.充电时,该电池的正极接电源的负极 |
某反应A + B =" C" + D 在低温下能自发进行,在高温下不能自发进行,对该反应过程△H、△S的判断正确的是()
| A.△H <0、△S >0 | B.△H >0、△S >0 |
| C.△H <0、△S <0 | D.△H >0、△S <0 |
下列说法正确的是()
A.某温度时, 1LpH=6的水溶液,含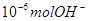 离子 离子 |
B.含10.6gNa2CO3溶液中,所含阴离子总数等于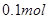 |
| C.VL amol/LFeCl3溶液中,若Fe3+离子数目为1mol,则Cl-离子数目大于3mol。 |
D.电解精炼粗铜时,每转移 电子,阳极上溶解的 电子,阳极上溶解的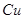 原子数必为 原子数必为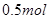 |