为确定木炭还原氧化铜后的固体成份,请你与兴趣小组的同学完成以下探究
【对固体猜想】
猜想I:全部是金属铜; 猜想Ⅱ:除铜外,还含有氧化铜;
猜想Ⅲ:除铜外,还含有木炭; 猜想Ⅳ:除铜外,还含有氧化铜、 。
【进行实验】实验流程见下图: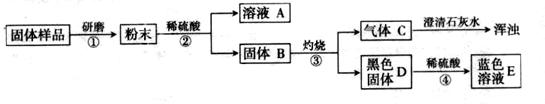 【问题与讨论】
【问题与讨论】
(1)步骤②包括溶解、 两步操作,它们共同用到的玻璃仪器是烧杯、 。
(2)C的化学式为 ,D的化学式为 ,由此推出固体B中含有 (写化学式),步骤④发生反应的化学方程式为 。
(3)结合(2)的结论推断:如果溶液A显蓝色,则溶液A的溶质的化学式为 ,说明样品中含有 ,则证明猜想 成立;如果溶液A无色,则证明猜想 成立。
为研究锌和铝的金属活动性,某研究小组进行了如下探究。
(1)小明设计的实验方案:向表面积相同的铝片和锌粒中分别加入盐酸。写出锌与盐酸反应的化学方程式。
(2)小芳将去膜和未去膜的铝片分别放入盐酸中,发现前者比后者反应快,原因是
。
(3)小芳在(2)实验中,还观察到有“灰黑色沉淀”这一异常现象出现。
【提出问题】铝与盐酸反应出现的灰黑色沉淀的组成是什么?
【查阅文献】铝在颗粒较小时为灰黑色;AlCl3为无色透明晶体或白色而微带浅黄色的固体,易溶于水和乙醇。
【提出合理假设】假设a:该灰黑色沉淀可能含有;
假设b:该灰黑色沉淀可能含有AlCl3;
假设c:该灰黑色沉淀可能含有难溶于酸的物质。
【设计并完成实验】取灰黑色沉淀分别进行如下实验。
| 实验编号 |
实验操作 |
实验现象 |
| ① |
加入适量稀盐酸 |
有微量气泡,固体全部溶解,得到澄清溶液 |
| ② |
加入适量蒸馏水 |
固体部分溶解 |
| ③ |
加入适量无水乙醇 |
固体部分溶解 |
【得出结论】由实验①可判断假设c(填“成立”或“不成立”),再集合②和③可得出该灰黑色沉淀的成分是。
注意:若答对(4)小题奖励4分,但化学总分不超过60分。
(4)你认为①中小明的实验能否比较锌和铝的金属活动性强弱?(填“能”或“不能”),分别从设计方法和操作可行性的角度,具体说明理由
。
探究活动一:在室温条件下进行如图所示实验。已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小均相同;同时加入两支试管中的稀盐酸的质量和质量分数均相等。
(1)该实验的目的是________、________。两支长颈漏斗中产生的现象的不同之处是____ ____。
(2)若实验所用的金属均过量,则甲装置中产生的H2比乙装置中产生的H2质量________(填“多”、“少”或“相等”)。(可能用到的相对原子质量:H-1 O-16 Mg-24 Cl-35.5 Fe-56)
探究活动二:为除去铜屑中混有的少量铁屑,并测定该混合物中铁的质量分数,现有如下A、B两组实验方案。 (3)两种方案,你认为不能达到目的的是________(填“A”或“B”),理由是________。
(3)两种方案,你认为不能达到目的的是________(填“A”或“B”),理由是________。
(4)在你所选取的方案中,若采用加热烘干的方式干燥滤渣,会导致测定的铁的质量分数________(填“偏大”、“偏小”、“不变”或“无法判断”)。
某同学家新换了淋浴喷头,从说明书上了解到该喷头是铜制镀铬的,他想起在学习金属性质时用到的金属活动性顺序中没有铬,为了了解铬与常见金属铝铜在金属活动性顺序中的相对位置关系,进行如下探究活动:
【查阅资料】①铬(Cr)是银白色有光泽的金属,在空气中表面能生成抗腐蚀的致密氧化膜;②铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液……
③铝是银白色有光泽的金属,能与稀硫酸反应,生成无色的硫酸铝溶液……
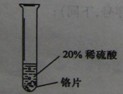
【实验过程】取大小相同的三种金属薄片,用砂纸打磨光亮.
| 实验一 |
实验二 |
实验三 |
|
| 实验方案 |
 |
 |
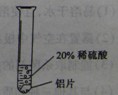 |
| 实验现象 |
铬片表面产生气泡缓慢,溶液变蓝色 |
无明显现象 |
铝片表面产生气泡较快 |
| 结论 |
铬能与稀硫酸发生反应,反应速率较慢 |
铜不与稀硫酸反应 |
铝能与稀硫酸发生反应,反应速率较快 |
| 三种金属在金属活动性顺序中的相对位置关系是 |
【回答问题】(1)用砂纸打磨金属片的目的是
(2)实验一所发生反应的化学方程式是
(3)甲同学提出用硫酸铜溶液代替上述实验中的稀硫酸,也能得出三种金属在金属活动性顺序中的相对位置关系,你认为(填“可行”或“不可行”).
(4)乙同学认为只要选用三种药品进行实验就可以得出三种金属在金属活动性顺序中的相对位置关系,这三种药品是.
【归纳】比较金属活动性强弱的方法有:
①
②通过金属与盐溶液反应判断金属活动性强弱.
小林同学对A、B、C三种金属的活动性进行探究,他分别将A、B、C三种金属放入三支盛有相同溶质质量分数的稀盐酸中,记录的实验现象为:A、C都能与盐酸反应放出气体,B放入稀盐酸中无明显现象。根据小林同学的记录,你对A、B、C三种金属的活动性能作出的判断是:、。不能作出的判断的是。要对A、B、C的金属活动性的相对强弱作出准确判断还需要做的实验是。
为了探究二氧化碳能否与水发生反应生成具有酸性的物质,A、B两同学分别设计了探究实验的方案。A同学的实验方案是将二氧化碳通入紫色石蕊试液中,观察溶液的颜色变化,如图甲所示。B同学的实验方案是取四朵用石蕊试液染成紫色的干燥的小花,按图乙进行实验,观察小花颜色变化(紫色石蕊试液遇酸变红色)。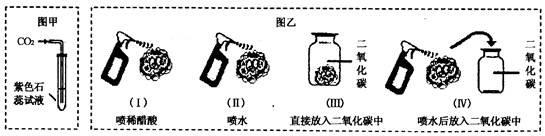
(1)图乙中,观察到纸花的颜色变化是:I.纸花变红 Ⅱ.Ⅲ.纸花不变色 Ⅳ.
写出实验Ⅳ中发生反应的文字表达式: 。
(2)哪个同学的方案合理。
(3)该方案合理的理由是。