某化学兴趣小组利用下图装置探究制取气体的原理、方法及性质。结合装置图,回答下列问题:
A B C D E
(1)写出图中标号仪器的名称:a 。
(2)用双氧水和二氧化锰制取氧气时,可选用的发生装置是 (填上图字母),可选用C装置收集氧气,其原因是 。
(3)实验室常用氯化铵固体与碱石灰固体共热来制取氨气(NH3),应选择的发生装置是 (填上图字母)。
(4)该小组设计了如下图所示的实验装置,既可用于制取气体,又可用于探究物质性质。
①当打开K1、关闭K2时,利用I、Ⅱ装置,可进行的实验是
(填字母)。
a.大理石与稀盐酸反应制取二氧化碳
b.锌与稀硫酸反应制取氢气
②当打开K2、关闭K1时,可以利用I、Ⅲ装置制得二氧化碳并验证其性质。实验室制取二氧化碳的化学方程式是 ;若要证明二氧化碳气体通入水中产生的物质是碳酸,应向烧杯的水中加入几滴 。
(10孝感11)、做菜用的一种嫩肉粉,其主要成分是碳酸氢钠(NaHCO3)可破坏肉质纤维结构、促进肉类吸收水分,从而使肉质松软、鲜嫩。小明发现将拌了嫩肉粉的肉类放到锅中并加入食醋等调料烧煮时产生了大量气体。他对此颇感兴趣,决定对其进行探究。
Ⅰ、小明对气体的成分进行了猜测:气体中除了醋酸气体之外,还可能含有水蒸气和CO2。
他设法收集气体样品并除去醋酸气体后,用右图实验装置进行探究。将气体依次通过A、B两试剂瓶后,发现A瓶质量增加,B瓶中有白色浑浊物产生。(已知浓硫酸具有吸水性)
实验结论:该气体中一定含有;
Ⅱ、小明对二氧化碳的来源做出了两种猜测:
猜测① 二氧化碳可能是由碳酸氢钠受热分解产生的;
猜测②;
针对以上猜测,小明设计了以下实验:(请你填写下表)
| 实验步骤 |
实验现象 |
实验结论 |
|
| 实验1 |
取碳酸氢钠样品少许加入试管中,加热到不产生气体为止,并把产生的气体通入澄清石灰水 |
试管口有小水滴产生 澄清石灰水变浑浊 |
猜想①正确 |
| 实验2 |
猜想②正确 |
Ⅲ、查阅资料:在百度网页中输入碳酸氢钠的化学性质,可以获知碳酸氢钠受热易分解,产物中有碳酸钠生成。再根据实验Ⅰ写出碳酸氢钠受热分解的化学方程式;
Ⅳ、实验Ⅰ中有白色粉末剩余,请用两种化学方法来验证剩余粉末是碳酸钠(写出实验操作步骤、现象和结论);
方法一:;
方法二:。
(10孝感8)、(5分)氢气具有还原性,能在加热条件下发生反应:H2+CuO Cu+H2O,某同学为了验证氢气还原氧化铜的产物,设计了如下由A、B、C三部分组成的实验装置。
Cu+H2O,某同学为了验证氢气还原氧化铜的产物,设计了如下由A、B、C三部分组成的实验装置。
(1)写出“a”所指仪器名称;
(2)能确认反应生成水的实验现象是;
(3)在实验室里利用A装置还可以制取那些气体?(只要求答一种)
(4)本实验缺少的仪器是;除此之外,上述实验装置还存在不足之处,为了达到实验目的,是根据现象得出的结论更严格更科学,请你提出修改意见。
(10河北35).某班同学做验证铁、铜、银的金属活动性顺序的实验,用到的药品有铁丝、铜丝、银丝、稀硫酸和硫酸铜溶液。实验结束后,化学兴趣小组的同学欲对该实验的废液进行探究,请你一起参与。
【提出问题】废液中含有什么物质?
【交流表达】
(1)小明通过观察,认为废液中一定含有硫酸铜。他观察到的现象是。
(2)小红通过分析,认为废液中一定含有硫酸亚铁,她的依据是:
。
【作出猜想】小华认为废液中还可能含有硫酸。
【实验验证】(1)小华测得废液的pH小于7,证明废液中含有硫酸。用pH试纸测定溶液pH的方法:。
(2)小明取少量废液,向其中滴加氢氧化钠溶液,也得到了相同的结论。小明的实验现象是。通过分析与实验,同学们得出废液中含有硫酸亚铁、硫酸铜和硫酸。
【拓展应用】
(1)若将废液中的溶质全部转化为硫酸亚铁,应向废液中加入过量的。写出该反应过程中的一个化学方程式。
(2)反应完全后,过滤,滤渣中物质为,滤液中溶质为硫酸亚铁。
.(10扬州27). (15分)叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
【应用研究】
(1)汽车经撞击后,30毫秒内引发NaN3,迅速分解为Na、N2,反应方程式为_______。
【制备研究】
(2)将金属钠与液态氨反应得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH3+N2O = NaN3+NaOH+X,实验室检验X气体使用的试纸是湿润________。
【Na2CO3质量分数测定】
工业级NaN3中常含有少量的Na2CO3,为测定样品中Na2CO3的质量分数设计如图
装置(已知H2SO4溶液与NaN3,反应不生成气体)。
(3)装置A的作用是_____。设计的实验步骤为:①精确称量样品,检查装置气密性;②打开弹簧夹,鼓入空气,称量装置C;③关闭弹簧夹,打开分液漏斗活塞;④再打开弹簧夹,_______;⑤再次称量装置C。计算碳酸钠含量至少需要测定______(填数字)个数据。根据制备反应,分析工业级NaN3中含有Na2CO3的可能原因_______。
【NaN3纯度测定】精确称量0.140 g NaN3样品,设计如图装置,测定其纯度。已知 (NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热。
(NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热。
(4)检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差_____(填“变大”、“变小”或“不变”),说明气密性良好。
(5)使小试管中的NaN3样品与M溶液接触的操作是______。
(6)使用冷水冷凝的目的是______。反应前应将液面调节到量气管的“0”刻度,并使两边液面相平,反应后读数时,还需要进行的操作是_______。
(7)常温下测得量气管读数为67.2 mL(N2的密度为1.25 g/L),则实验中选用的量气管规格合适的是_____(填字母序号)。
A. 100 mL B. 1 L C. 2 L
(8)计算NaN3样品的纯度(写出计算过程)。
(10扬州26.) (10分)某研究性学习小组探究CuSO4溶液与NaOH溶液的反应产物。
(1)两溶液混合生成蓝色沉淀的化学方程式是_______。沉淀放置一段时间后,完全变为黑色沉淀,猜想是CuO。为验证猜想,将沉淀过滤、洗涤、烘干后,用CO还原得到红色物质,且生成的气体能使________,写出CO与CuO反应的化学方程式________。
(2)CuSO4溶液与NaOH溶液反应有时也会生成浅绿色沉淀 [化学式为CuSO4·3Cu(OH)2]和Na2SO4,则反应方程式为________。
(3)为探究新制Cu(OH),的分解温度,设计水浴加热装置(如图)。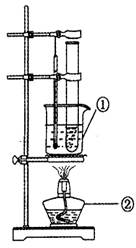
写出仪器的名称:①_______②_______。该装置采用水浴加热,其目的是_______。
(4)18℃时,将溶质质量分数均为10%的CuSO4溶液与NaOH溶液
混合后,测得混合液温度为22℃,说明该反应_____(填“放热”或“吸热”)。当水浴温度分别为30℃、60℃、90℃时,黑色沉淀出现的时间为:2分钟、6秒、1秒,则说明温度越高,Cu(OH)2分解速率越_____(填“快”或“慢”)。该实验说明,Cu(OH)2分解温度________(填“无确定数值”或 “有确定数值”)。