化学课后,化学兴趣小组的同学在整理实验桌时,发现有一瓶氢氧化钠溶液没有塞橡皮塞,征得老师同意后,开展了以下探究:
[提出问题1] 该氢氧化钠溶液是否变质了呢?
[实验探究1]
| 实验操作 |
实验现象 |
实验结论 |
| 取少量该溶液于试管中,向溶液中滴加稀盐酸,并不断振荡。 |
|
氢氧化钠溶液一定变质了。 |
[提出问题2] 该氢氧化钠溶液是全部变质还是部分变质呢?
[猜想与假设]
猜想1:氢氧化钠溶液部分变质。 猜想2:氢氧化钠溶液全部变质。
[查阅资料] 氯化钡溶液呈中性。
[实验探究2]
| 实验步骤 |
实验现象 |
实验结论 |
| (1)取少量该溶液于试管中,向溶液中滴加过量的氯化钡溶液,并不断振荡。 |
有 生成。 |
说明原溶液中一定有碳酸钠。 |
| (2)取步骤(1)试管中的少量上层清液,滴加酚酞溶液。 |
溶液变红色。 |
说明原溶液中一定有 。 |
[实验结论] 该氢氧化钠溶液 (填“部分”或“全部”)变质。
[反思与评价]
在上述[实验探究2]中,小明提出可用氢氧化钙溶液代替氯化钡溶液,你认为该方案 (填“可行”或“不可行”),理由是
[理解与应用] (1) 氢氧化钠溶液容易变质,必须密封保存。实验室必须密封保存的药品还有很多,试另举一例: 。
(2)取上述部分变质的氢氧化钠溶液100g,向其中加入足量的氢氧化钡溶液,完全反应后得到1.97g白色沉淀,求上述氢氧化钠溶液中碳酸钠的质量分数。(写出计算过程)
化学实验课后,兴趣小组的同学在整理实验桌时,发现有一瓶氢氧化钠溶液没有塞橡皮塞,征得老师同意后,开展了以下探究:
【提出问题1】该氢氧化钠溶液是否变质了呢?
【实验探究1】
| 实验操作 |
实验现象 |
实验结论 |
| 取少量该溶液于试管中,向溶液中滴加,并不断振荡。 |
有产生。 |
氢氧化钠溶液已经变质。 |
【提出问题2】该氢氧化钠溶液是全部变质还是部分变质呢?
【猜想与假设】猜想1:氢氧化钠溶液部分变质。猜想2:氢氧化钠溶液全部变质。
【查阅资料】(1)氯化钙溶液呈中性。
(2)氯化钙溶液能与碳酸钠溶液反应:CaCl2+Na2CO3=CaCO3↓+2NaCl
【实验探究2】
| 实验步骤 |
实验现象 |
实验结论 |
| (1)取少量该溶液于试管中,向溶液中滴加过量的氯化钙溶液,并不断振荡。 |
有产生。 |
说明原溶液中一定有 碳酸钠。 |
| (2)取步骤(1)试管中的少量上层清液,滴加酚酞溶液。 |
。 |
说明原溶液中。 |
【实验结论】该氢氧化钠溶液(填“部分”或“全部”)变质。
【反思与评价】
(1)氢氧化钠溶液露置于空气中容易变质,写出相关反应的化学方程式。
(2)保存氢氧化钠的方法是。
(3)在上述【实验探究2】中,小明提出可用氢氧化钙溶液代替氯化钙溶液,你认为该方案(填“可行”或“不可行”)。
某化学兴趣小组在甲、乙两个充满O2的密闭容器中各加入一定量的碳粉,在高温条件下使其充分反应,待反应结束后,两个容器中的碳粉都已完全消失.该小组成员对两容器中反应后的气体进行如下探究:
(1)小红同学对甲容器中气体的组成提出如下四种猜想:
①只有CO②只有CO2③只有O2④CO和O2的混合气体
你认为上述猜想中明显不合理的有______(填序号).
(2)小明同学认为甲容器中的气体还可能是CO和CO2的混合气体,为了验证自己的猜想,他准备按下图所示装置进行探究.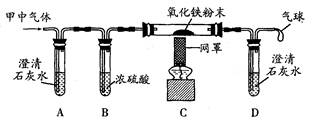
请你回答下列问题:已知装置B中浓硫酸可以用作干燥剂,用于吸水。
若小明的猜想成立,则装置A中的实验现象是_______,反应的化学方程式是____.装置C玻璃管中的实验现象是_______,反应的化学方程式是_____________.
(3)小芳同学对乙容器中气体的组成提出了除上述猜想外的另一种合理猜想,她的猜想是_______,于是她设计了下列实验方案验证其猜想:
【步骤1】先加热装有铜丝网的玻璃管一段时间后,再通入乙中的气体,观察现象.
【步骤2】将乙中的气体通入澄清石灰水中,观察现象.
指导老师在分析其实验方案后,指出了其中存在的错误或不足.
①步骤1应先通入乙中气体一段时间后方可加热,你认为这样修改的原因是____.
②没有必要进行步骤2的实验,其理由是_______________________.
(10分)暑假,同学们在帮老师整理实验室时,发现一瓶石灰水试剂瓶瓶壁和瓶塞周围有一些白色粉末。为了弄清楚白色粉末的成分及形成原因,他们进行了如下探究:
(1)对白色粉末成分的猜想和形成原因分析:
| 白色粉末的成分 |
形成的原因 |
| 可能是CaCO3 |
石灰水与空气中CO2反应; 化学方程式为: |
| 可能是 |
气温较高时,溶质的溶解度或溶剂蒸发,石灰水中的溶质结晶析出。 |
经过反复思考,同学们认为白色粉末还可能是的混合物。
(2)他们取白色粉末于一试管中加水溶解后,进行了实验探究,请完成实验报告:
| 实验步骤 |
可能观察到的现象 |
结论 |
| 取上述试管中的上层清液,滴加1~2无色酚酞试液。 |
① |
② |
| 往上述试管中的残留的固体中加入稀盐酸。 |
③ |
④白色粉末中(选填“有”或“无”)CaCO3 |
| 由上述实验可知白色粉末的成分是:。 |
(3)交流与反思:
通过上述实验的探究,同学们向实验室提出保存、使用易变质的溶液时的下列建议,合理的是(选填序号)。
A.密封保存B.使用前,临时配制 C.禁止使用这种试剂
小雨同学阅读课外资料得知,双氧水分解除了二氧化锰作催化剂,还可以用氧化铜等物 质作催化剂,于是她对氧化铜产生了探究兴趣。
【提出问题】氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
【设计实验】小雨以生成等体积的氧气为标准,设计了下列三组实验:(其他可能影响 实验的因素均忽略)
| 实验序号 |
KClO3质量 |
其他物质质量 |
待测数据 |
| ① |
1.2g |
||
| ② |
1.2g |
CuO 0.5g |
|
| ③ |
1.2g |
MnO2 0.5g |
(1)上述实验测量的“待测数据”是。
(2)若实验②比实验①的“待测数据”更(填“大”或“小”),说明氧化铜能加快氯酸钾的分解速率。
(3)对实验②反应后的固体加水溶解、过滤、洗涤、干燥,称量得到0.5g黑色粉末,经进一步实验证实过滤所得的黑色固体粉末为氧化铜。
【预期结论】氧化铜还能作氯酸钾分解的催化剂。
【评价设计】你认为小雨设计实验③和实验②对比的目的是。
【实验拓展】小雨同学从课外资料上还获得下列信息:氧化铁、硫酸铜、猪肝、马铃薯等也可以作过氧化氢分解的催化剂。下列有关催化剂的说法正确的是。
A.二氧化锰一定是催化剂
B.同一个反应可能有多种催化剂
C.催化剂一定是加快反应速率
D.也存在减慢反应速率的催化剂
E.对一定量的反应物来说,催化剂能改变生成物的质量
“滴水生火”魔术:向包有淡黄色过氧化钠(Na2O2)粉末的脱脂棉上滴加水,脱脂棉随即燃烧。某同学对该“魔术”很感兴趣,设计实验进行探究。
【提出问题】过氧化钠与水反应生成什么物质? 脱脂棉为什么会燃烧?
【实验1】取一支干燥的大试管,加入少量过氧化钠粉末,滴加蒸馏水,观察到试管内发生剧烈反应,产生大量气泡,用手触摸,试管底部发烫。
【提出猜想】生成的气体产物可能是:①;②。
【实验2】为探究气体产物,进一步设计并完成如下实验。
请完成表中空格:
| 操作 |
现象 |
结论 |
| 将带火星的木条伸入试管 |
带火星的木条复燃 |
气体产物是 |
【查阅资料】脱脂棉是经过化学处理去掉脂肪的棉花,极易燃烧;过氧化钠与二氧化碳反应生成碳酸钠和氧气。
【实验结论】
①过氧化钠与水的反应是反应(填“吸热”或“放热”)。
②脱脂棉燃烧的原因。
③扑灭由过氧化钠引发的火灾时,可以选择的灭火材料是。
A.二氧化碳 B.水 C.沙子