有NaCl、FeCl2、FeCl3、AlCl3、MgCl2五种溶液,只需一种试剂就可把它们鉴别开来,这种试剂是
| A.盐酸 | B.烧碱溶液 | C.氨水 | D.KSCN溶液 |
小军利用家中的废旧材料制作了一个可使玩具扬声器发出声音的电池,装置如图所示。下列有关该电池工作时的说法错误的是()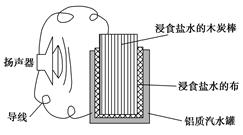
| A.铝质汽水罐将逐渐被腐蚀 |
| B.电子流向为铝质汽水罐→导线→扬声器→导线→木炭棒 |
| C.食盐水中的Na+向木碳棒移动 |
| D.木炭棒上发生的反应为2H++2e-=H2↑ |
依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s),设计的原电池如图所示。下列有关说法中错误的是()
| A.电解质溶液Y是CuSO4溶液 |
| B.电极X的材料是Cu |
| C.银电极为电池的正极,其电极反应为Ag++e-=Ag |
| D.外电路中的电子是从X电极流向Ag电极 |
下列防腐措施中,利用原电池反应使主要金属得到保护的是()
| A.用氧化剂使金属表面生成致密稳定的氧化物保护膜 |
| B.在金属中加入一些铬或镍制成合金 |
| C.在轮船的壳体水线以下部分装上锌锭 |
| D.金属表面喷漆 |
生物燃料电池(BFC)是以有机物为燃料,直接或间接利用酶作为催化剂的一类特殊的燃料电池,其能量转化效率高,是一种真正意义上的绿色电池,其工作原理如图所示。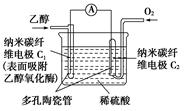
已知C1极的电极反应式为:C2H5OH+3H2O-12e-=2CO2+12H+。下列有关说法不正确的是()
A.C1极为电池负极,C2极为电池正极
B.电子由C2极经外电路导线流向C1极
C.C2极的电极反应式为O2+4H++4e-=2H2O
D.该生物燃料电池的总反应式为:C2H5OH+3O2=2CO2+3H2O
一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通入乙烷(C2H6)和氧气,其中某一电极反应式为C2H6+18OH--14e-=2CO32-+12H2O。有关此电池的推断不正确的是()
| A.通入氧气的电极为正极 |
| B.参加反应的O2与C2H6的物质的量之比为7∶2 |
| C.放电一段时间后,KOH的物质的量浓度将下降 |
| D.放电一段时间后,正极区附近溶液的pH减小 |