化学与人类生活、社会可持续发展密切相关,下列措施不利于节能减排、保护环境的是
| A.加快化石燃料的开采与使用 |
| B.研发易降解的生物农药 |
| C.推广使用节能环保材料 |
| D.应用高效洁净的能源转换技术 |
氢气、一氧化碳、辛烷、甲烷的热化学方程式分别为:
H2(g)+1/2O2(g)=H2O(l);△H=-285.8 kJ / mol
CO(g)+1/2O2(g)=CO2(g);△H=-283.0 kJ / mol
C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l);△H=-5518 kJ / mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890.3 kJ / mol
相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时,放出热量最少的是
| A.H2(g) | B.CO(g) | C.C8H18(l) | D.CH4(g) |
下列说法 或表示法正确的是
或表示法正确的是
| A.等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
B.由C(石墨)→C(金刚石) ΔH =" +119" kJ·mol—1可知,金刚石比石墨 稳定 稳定 |
C.在稀溶液中:H++OH-==H2O ΔH  = -57.3 kJ· mol—1,若将含1mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液混合,放出的热量小于57.3 kJ = -57.3 kJ· mol—1,若将含1mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液混合,放出的热量小于57.3 kJ |
D.在101 kPa时,2 g H2完全燃烧 生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+ O2(g)==2H2O(l) ΔH =" +285.8" kJ· mol—1 生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+ O2(g)==2H2O(l) ΔH =" +285.8" kJ· mol—1 |
下列关于反应热的说法正确的是
| A.当∆H为“-”时,表示该反应为吸热反应 |
B.已知C(s)+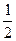 O2(g)=CO(g)的反应热为-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol O2(g)=CO(g)的反应热为-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol |
| C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 |
| D.化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关 |
下列说法中正确的是
| A.在化学反应过程中,发生物质变化的同时不一定发生能量变化 |
| B.生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,反应为吸热反应 |
| C.反应产物的总焓大于反应物的总焓时,反应吸热,ΔH>0 |
| D.ΔH的大小与热化学方程式的计量系数无关 |
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是①天然气②煤③核能④石油⑤太阳能⑥生物质能⑦风能⑧氢能
| A.①②③④ | B.⑤⑥⑦⑧ | C.③⑤⑥⑦⑧ | D.③④⑤⑥⑦⑧ |