在化学科学研究中,物质发生化学反应的反应热可通过实验测定,也可通过化学计算的方式间接地获得。
⑴实验方法测反应反应热
①中和热测定
实验中所需要使用的玻璃仪器除烧杯、量筒外还需要 、 。
为了减少实验误差:实验过程中将NaOH溶液 (选填“一次”或“分多次”)倒入盛有盐酸的小烧杯中;溶液混合后,准确读取混合溶液的 ,记为终止温度。
②实验测定在一定温度下,0.2 molCH4(g)与足量H2O(g)完全反应生成CO2(g)和H2(g)吸收33 kJ的热量。该反应的热化学方程式 。
⑵通过化学计算间接获得
①已知拆开1mol的H—H键、I—I、H—I键分别需要吸收的能量为436kJ、153kJ、299kJ。
则反应H2(g)+I2(g)=2HI(g)的反应热△H= kJ·mol-1
②工业生产甲醇的常用方法是:CO(g)+2H2(g)=CH3OH(g) △H=-90.8 kJ·mol-1。
已知:2H2(g)+ O2(g) = 2H2O (l) △H=-571.6 kJ·mol-1
H2(g)+ O2(g) = H2O(g) △H=-241.8 kJ·mol-1
O2(g) = H2O(g) △H=-241.8 kJ·mol-1
根据上述反应确定:H2燃烧热为 kJ·mol-1;
CH3OH(g)+O2(g) = CO(g)+2H2O(g) △H= kJ·mol-1
某同学为了验证Fe3+是否能氧化H2SO3生成了SO42–,他用50mL0.1mol/LFeCl3溶液吸收制取SO2气体的尾气,进行以下实验:
(1)检验吸收液中的SO42–: __________
_____________________________________________,证明Fe3+能够把H2SO3氧化成SO42–。
(2)请配平并完成上述反应中的化学方程式:
2FeCl3+SO2+==2FeCl2+H2SO4+2HCl,反应中的还原剂是 _____ (写化学式)。
(3)吸收液中除了含有H+、Cl–、SO42–以外,对其它成份(Fe3+、Fe2+、H2SO3)的可能组合进行探究:
①提出假设。
假设1:溶液中存 在Fe3+、Fe2+;
在Fe3+、Fe2+;
假设2:溶液中存在;
假设3:溶液中存在Fe2+ 而不存在H2SO3(二者恰好完全反应)。
②设计方案、进行实验,验证假设。请在表中写出实验步骤以及预期现象和结论(可以不填满)。限选实验试剂和仪器:试管、滴管、0.1moL L-1KMnO4、0.1moL
L-1KMnO4、0.1moL L-1KSCN溶液、品红
L-1KSCN溶液、品红 稀溶液。
稀溶液。
| 实验步骤 |
预期现象和结论 |
| 步骤1:用试管取样品溶液2-3mL,再用滴管取 |
若出现血红色,则假设1成立;若未出现血红色,则假设2或假设3成立。 |
| 步骤2: |
结合步骤1的现象和结论, ________________________________________. |
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯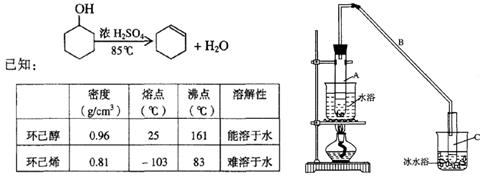
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是,导管B除了导气外还具有的作用是。
②试管C置于冰水浴中的目的是。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在层(填上或下),分液后用_________(填入编号,单选)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3 溶液
溶液
②再将环己烯按下图装置蒸馏,冷却水从_________口进入,目的是_____________________________。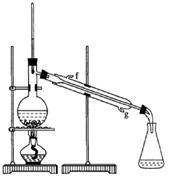
③收集产品时,控制的温度应在_________左右 ,实验制得的环己烯精品质量低于理论产量,可能的原因是(单选)
,实验制得的环己烯精品质量低于理论产量,可能的原因是(单选)
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
用图示装置制取PCl3,在E中放入足量白磷,将氯气不间断地通入E,氯气与白磷就会发生反应,并放出热量(温度高于75℃)。已知:PCl3和PCl5遇水强烈反应,它们熔沸点数据如下: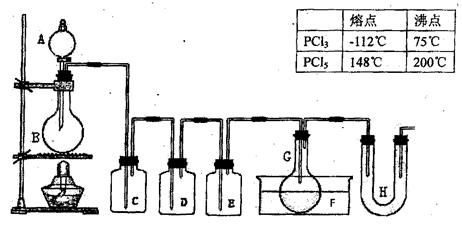
请根据图中装置回答下列问题:
(1)检查该装置气密性的方法是。
(2)为得到氯气,若B中加入MnO2,则A中应加入 ,发生反应的化学方程式为。
,发生反应的化学方程式为。
(3)若发现C中气泡产生过猛,需要进行的操作的关键是。
(4)在反应开始时主要生成PCl3,而后来主要生成PCl5,原因可能是;从PCl3和PCl5的混合物中分离也PCl3的最佳方法是(选填序号)。
a.蒸馏 b.分液 c.升华
(5)生成的PCl3在G中收集,则F中盛有,作用是
(6)C、D、H所盛的试剂分别是:C;D ;H。
;H。
(7)如果E中反应放热较多,G处的导管可能发生堵塞,其原因 是。
是。
(1)写出实验室由苯和浓硝酸反应制取硝基苯的化学方程式:.
该反应属于反应。
(2)如图所示的实验装置图中存在哪些错误?请指正。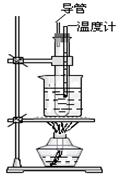
①;
②;
③。
(3)在试管中将两种浓酸混和的操作方法是
(4)试简述水浴加热的优点。
某学生用0.1 mol/L的KOH标准溶液滴定未知浓度盐酸,其操作分解为如下几步:
| A.移取20 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞 |
| B.用标准溶液润洗滴定管2~3次 |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液 |
| D.取标准KOH溶液注入碱式滴定管至0刻度以上2-3 cm |
E.调节液面至0或0以下刻度,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空
(1)正确操作步骤的顺序是(用序号字母填写)____________________________;
(2)上述B步骤操作的目的是________________________________________________;
(3)上述A步骤操作之前,先用待测液润洗锥形瓶,则对滴定结果的影响是________;
(4)判断到达滴定终点的实验现象是_____________________________________;
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸则对滴定结果产生的影响是____________________________________。