常温下,用 0.1000 mol·L-1NaOH溶液滴定 20.00mL0.1000 mol·L-1CH3COOH溶液,pH的变化如图1所示。
⑴根据图1,用化学符号表示滴定过程中溶液中微粒之间的关系
①点a处: c(CH3COO-)+c(CH3COOH) = 。
②点b处:溶液中离子浓度大小关系: 。
③点c处:c(CH3COOH)+c(H+) = 。
⑵甲同学也用0.1000 mol·L-1NaOH溶液滴定 20.00mL0.1000 mol·L-1CH3COOH溶液进行滴定实验,该同学所绘制的滴定曲线如图2所示。图2中有一处明显错误,请指出错误的原因:
。
⑶乙同学设计了用0.1000 mol·L-1标准盐酸滴定20.00mL未知浓度氨水的中和滴定实验。
①0.1000 mol·L-1标准盐酸应盛放在 (填仪器名称)中。
②为减少实验误差,指示剂应选用: 。
③滴定过程中眼睛始终注视 。
④若实验中锥形瓶用待盛放的未知浓度氨水润洗,则测定结果将 。(选填“偏高”、“偏低”或“不影响”)
⑷实验室配制pH相等的CH3COONa溶液、NaOH溶液和Na2CO3溶液,三种溶液中溶质的物质的量浓度分别为c1、c2、c3,比较c1、c2、c3的大小关系:
< < 。
固体X是由两种常见元素组成的化合物,其中金属元素与另一元素的质量比为14∶1。在一定条件下X可发生如下框图的转化关系,有的反应标出全部产物,有的反应标出部分产物。已知P为两种气体的混合物,R是无色无味能使澄清石灰水变浑浊的气体,C为红褐色物质,M为常见金属单质,Q为常见非金属单质。试填空。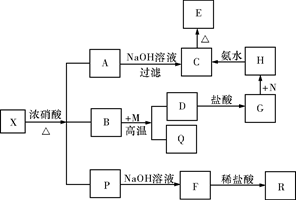
(1)X的化学式为 ,P中气体的化学式为 。
(2)实现G→H,欲不引进新的杂质,N可以选择下列物质中的 (填序号)。
①KMnO4 ②HNO3 ③H2O2 ④Cl2
(3)写出B和M反应的化学方程式: 。
(4)已知P中有一种气体与氢氧化钠溶液反应可生成两种正盐,该反应的离子方程式为 。
某班级同学查阅资料,对Na2S有了一定的认识,并提出了以下几个问题,请回答:
(1)1000℃时,在密闭容器中加入一定量的Na2SO4固体使其发生以下反应达到平衡:
Na2SO4(s)+4H2(g)  Na2S(s)+4H2O(g) ΔH>0若反应在恒温恒容状态下进行,回答以下问题:
Na2S(s)+4H2O(g) ΔH>0若反应在恒温恒容状态下进行,回答以下问题:
向容器中分别加入以下物质,判断对平衡有无影响,有影响的填写出平衡移动的方向。
①加入Na2SO4 。②加入焦炭 。
(2)向Na2S的浓溶液中逐滴加入稀盐酸,直到不再生成H2S气体为止,则在此过程中,溶液的c(HS-)变化趋势可能是 。
a.逐渐减小b.逐渐增大
c.先逐渐增大,而后减小 d.先逐渐减小,而后增大
(3)Na2S溶液与下列溶液混合,不能发生反应的是 。
①H2S ②SO2 ③Na2SO3 ④酸性KMnO4溶液 ⑤CuSO4⑥氯水
(4)写出Na2S和AlCl3溶液反应的离子方程式 。
将一定质量的Al、Fe混合物加入到足量的盐酸中,充分反应后得到标准状况下的氢气8.96L;如 果将等质量的该混合物加入到足量的NaOH溶液中,充分反应后得到标
果将等质量的该混合物加入到足量的NaOH溶液中,充分反应后得到标
准状况下的氢气6.72L。
(1)写出涉及到的化学方程式:_________ ____________________________
____________________________
(2)混合物中Al和Fe的质量分别为________和__________
(3)当混合物与盐酸反应时,转移电子数为_______mol;与NaOH溶液反应时转移电子数为_______mol。
有A、B、C、D、E 5种透明溶液,分别是HCl、BaCl2、NaHSO4、Na2CO3
和AgNO3中的一种。已知:
①A和B反应有气体生成;
②B与C反应有沉淀生成
③C与D反应有沉淀生成
④D与E反应有沉淀生成
⑤A与E反应有气体生成
⑥在②和③的反应中生成的沉淀为同一种物质
(1)在②和③反应中生成的沉淀为同一种物质,其化学式为________。
(2)写出各物质的化学式:A ________、B__________、C___________、D_________、E________。.
(3)A和E反应的离子方程式为_____________________________。
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) = 4NO(g)+CO2(g) + 2H2O(g)ΔH1=-574 kJ·mol-1
CH4(g) + 4NO(g) =" 2" N2(g)+CO2(g) + 2H2O(g)ΔH2
若1 mol CH4 还原NO2 至N2,整个过程中放出的热量为867 kJ,则ΔH2=;
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为: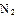 +3
+3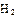
 2
2 ,则在电化学合成氨的过程中,阴极反应式为;
,则在电化学合成氨的过程中,阴极反应式为;
(3)在一定条件下,将l mol N2 与3 mol H2 混合于一个10 L密闭容器中,反应达到平衡时,A点混合气体中氨占25%,试回答:
①N2的转化率为;
②右图中在状态A时,平衡常数 KA(填写代入数值的表达式,不要求算出具体数值);当温度由T1变化到T2时, KA KB(填“>”、“<”或“=”)。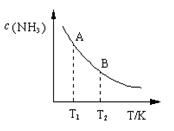
③在容积固定的密闭容器中发生上述反应,各物质的浓度如下表: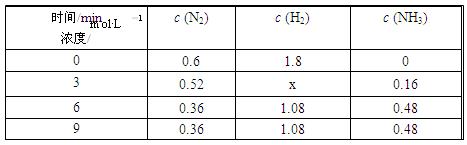
反应从0 min到3 min之间,H2的反应速率为;反应在3 min时,条件发生了改变,改变的条件可能是(填序号)。
a.使用催化剂 b.降低温度 c.增加H2的浓度