道尔顿的原子学说曾经起了很大的作用。他的学说中,包含有下述三个论点:①原子是不能再分的粒子;②同种元素的原子的性质和质量都相同;③原子是微小的实心球体。从现代的观点看,你认为这三个论点中,不确切的是( )
| A.只有③ |
| B.只有①③ |
| C.只有②③ |
| D.①②③ |
下列物质不属于“城市空气质量日报” 报
报 道的是()
道的是()
| A.二氧化硫 | B.氮氧化物 | C.二氧化碳 | D.悬浮颗粒 |
从海水中提取镁,没有涉及到的化学反应是()
| A.Mg2+ + 2OH- ="=" Mg(OH)2↓ | B.Mg(OH)2 + 2HCl ="=" MgCl2 + H2O |
C.Mg(OH)2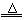 MgO + H2O MgO + H2O |
D.MgCl2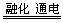 Mg + Cl2↑ Mg + Cl2↑ |
分离下列各组混合物时,可以按溶解、过滤、蒸发的顺序操作的是()
| A.氢氧化钠和氯化钠 | B.氧化铜和铜粉 |
| C.碳酸钠和碳酸钙 | D.氯化钡和硝酸钡 |
镍镉电池在通讯、交通及日常生活中有着广泛的应用,其工作原理可以表示为:Cd+2NiO(OH)+2H2O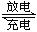 2Ni(OH)2+Cd(OH)2以下说法中正确的是:()
2Ni(OH)2+Cd(OH)2以下说法中正确的是:()
| A.以上反应是可逆反应 |
| B.放电时,镉为正极 |
| C.充电时电池上标有“+”号的电极连接电源负极 |
D.以镍镉电池为电源,电解Na2CO3溶液,当收集到气体的总体积为33.6L (标况下)时,电池中转移了2mol电子 (标况下)时,电池中转移了2mol电子 |
中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验,下列说法不正确的是()
| A.改用60mL 0.50mol/L盐酸跟50mL 0.55 mol/L NaOH溶液进行反应,求出的中和热数值和原来相同 |
| B.用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验比用50mL0.50mol/L盐酸和50mL0.50mol/LNaOH测得的数值准确 |
| C.酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌 |
| D.装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失 |