1L某混合溶液中,溶质X、Y的浓度都为0.1mol/L,向混合溶液中滴加某溶液Z(0.1mol/L的氢氧化钠或硫酸溶液),所得沉淀的物质的量随着Z溶液的体积变化关系如图所示,则X、Y、Z分别是( )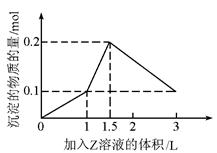
| A.AlCl3、FeCl3、NaOH |
| B.AlCl3、MgCl2、NaOH |
| C.NaAlO2、Ba(OH)2、H2SO4 |
| D.NaAlO2、BaCl2、H2SO4 |
有关下列的说法正确的是()
| A.浓硫酸具有脱水性,因此实验室可用浓硫酸与浓盐酸制取少量HCl气体 |
| B.钠是活泼金属,可用电解NaCl溶液的方法获得金属钠 |
| C.碳酸钠溶液显碱性,用热的碳酸钠溶液可去除金属表面的油污 |
| D.在电热水器的钢铁内胆中装入铜棒可以防止内胆被腐蚀 |
下列有关化学用语表示正确的是()
A.NH3的电子式: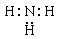 |
B.CS2分子的球棍模型: |
| C.二氧化硅的分子式:SiO2 |
| D.Mg5(Si4O10)2(OH)2•4H2O的氧化物形式:5MgO•8SiO2•5H2O |
生产、生活离不开化学。下列说法中不正确的是()
| A.高纯硅是工业上制造光导纤维的主要原料 |
| B.开发和推广新能源汽车是实现低碳生活的途径之一 |
| C.寻找高效催化剂,利用太阳能分解水是制取氢气的较理想方法 |
| D.不需要通过化学反应就能从海水中获得淡水 |
基态碳原子的最外能层的各能级中,电子排布的方式正确的是()
若n=3,以下能级符号错误的是()
| A.np | B.nf | C.nd | D. ns |