填空回答:
(1)氮化硅是一种高温陶瓷材料。根据元素周期律知识,写出氮化硅的化学式: 。
(2)有A、B、C、D、E、F六种元素,它们均属短周期元素,其原子序数依次增大,它们两两形成的化合物有以下几种:
| 形成的化合物 |
甲 |
乙 |
丙 |
丁 |
戊 |
| 化合物中各元素的原子个数比 |
A:C=2:1 |
B:A=1:3 |
D:C=1:1 |
E:F=1:3 |
A:F=1:1 |
已知A、B两元素的核电荷数之差等于其原子最外层电子数之和;B原子最外层电子数比次外层电子数多3个;C原子的最外层电子数是次外层电子数的3倍;D、E、F同周期,D、A同主族;E与F的原子序数之和为30,丙是离子化合物。回答:
① F元素位于周期表中的位置 。
② E元素的原子结构示意图为 ,B的最高价氧化物的水化物的化学式为 。
③向丙物质中滴加甲的化学反应方程式为 。
氧化铁在工业上具有广泛的应用。
I.据报道,一定条件下利用FeO2与甲烷反应可制取“纳米级”的金属铁。其反应如下:
Fe2O3(s)+3CH4(g)=2Fe(s)+3CO(g)+6H2(g)△H>0
(1)若反应在2L的密闭容器中进行,5min后达到平衡,测得反应生成Fe的质量为l.12g。则该段时间内CH4的平均反应速率为 ________________。
(2)反应达到平衡后,保持其他条件不变,仅改变某一相关元素,下列说法正确的是___(选填序号)。
a.若加入催化剂,v正增大,平衡向右移动
b.若温度升高,平衡常数K减小
c.若增大Fe2O3的量,平衡向右移动
d.若从反应体系中移走部分CO,可提高CH4的转化率
Ⅱ.工业上利用硫铁矿烧渣(主要成分为Fe2O3、A12O3、SiO2等)为原料提取Fe2O3,工艺
流程如下:试回答下列问题:
(3)步骤i烧渣中A12O3溶解的离子方程式为________________。
(4)步骤i、ⅱ、ⅲ都要进行的操作名称是__________________。
(5)结合下图,判断步骤ⅱ中调节溶液的pH不高于_________________。
(6)已知
计算反应Fe2+(aq)+2HCO3-(aq) FeCO3(s)+H2CO3(aq)的平衡常数为_______。
FeCO3(s)+H2CO3(aq)的平衡常数为_______。
(7)在空气中煅烧FeCO3生成氧化铁的化学方程式为____________。
(8)结合所学化学知识,请你设计在实验室里从上述的硫铁矿烧渣中提取氧化铁的另一种简单方案。
短周期元素R、Q、M、T在元素周期表中的相对位置如下表,已知R原子最外层电子数与次外层电子数之比为2:1。
(1)人的汗液中台有T的简单离子,其离子结构示意图为_________________;元素M在元素周期表中的位置是___________________。
(2)R的最高价氧化物所含的化学键类型是__________键(选填“离子”或“共价”)。
(3)加热时,Q的最高价氧化物对应水化物的浓溶液与单质R反应的化学方程式为__________(用具体的化学式表示)。
(4)在一定条件下甲、乙、丙有如下转化:甲 乙
乙 丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则甲的化学组成不可能是________(选填序号,下同)。
丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则甲的化学组成不可能是________(选填序号,下同)。
①R②Q2③M④T2
(5)工业上,常利用。RO与MO2反应生成固态M单质和RO2,从而消除这两种气体对大气的污染。
已知:2RO(g)+O2(g)=2RO2(g)△H=-akJ·mol-l
M(s)+O2(g)=MO2(g)△H=-bkJ·mol-l
则反应2RO(g)+MO2(g)=2RO2(g)+M(s)△H=___________。
(6)元素T的含氧酸HTO具有漂白性。往20mL 0.0lmol·L-l的HTO溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如下图所示。据此判断:该烧碱溶液的浓度为______________mol·L-l;下列有关说法正确的是_______________。
①HTO的电离常数:b点>a点
②由水电离出的c(OH—):b点<c点
③从a点到b点,混合溶液中可能存在:c(TO—)= c(Na+)
④从b点到c点,混合溶液中一直存在:c(Na+)>c(TO-)>c(OH-)>c(H+)
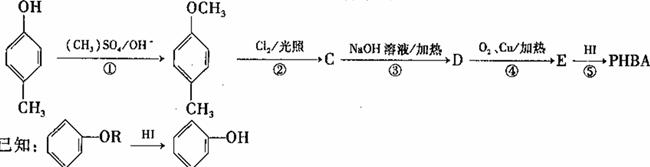
对羟基苯甲醛,俗称PHBA,是-种重要的有机化工原料。其结构如图所示。有人提出,以对甲基苯酚为原料合成PHBA的途径如下: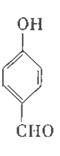
 (1)PHBA的官能团的名称为_______。
(1)PHBA的官能团的名称为_______。
(2)下有关PHBA的说法正确的是_______。
| A.PHBA的分子式为C7H6O2 | B.PHBA是一种芳香烃 |
| C.1mo1PHBA最多能与4mo1H2反应 | D.PHBA能与NaHCO3溶液反应生成CO2 |
(3)上述反应中属于取代反应的_______。
(4)反应③的化学方程式为_______。
(5)该合成途径中的反应①⑤的作用为_______。
(6)E有多种同分异构体,符合以下所有特征的同分异构体的结构简式为______ (只写一种)。
a.苯环上存在2种不同化学环境的氢原子,且个数比为1:2
b.遇FeCL3 溶液显示特征颜色
c.能使溴的四氯化碳溶液褪色
I.S4N4的结构如图: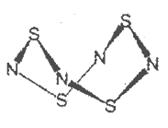
(1)S4N4的晶体类型是___。
(2)用干燥的氨作用于S2Cl2的CCl4,溶液中可制S4N4,化学反应方程为:6S2Cl2+16NH3=S4N4+S8+12NH4Cl
①上述反应过程中,没有破坏或形成的微粒间作用力是___;
a离子键;b极性键;c非极性键;d金属键;e配位键;f范德华力
②S2Cl2中,S原子轨道的杂化类型是___。
II.二甘氨酸合铜(II)是最早被发现的电中性内配盐,它的结构如图: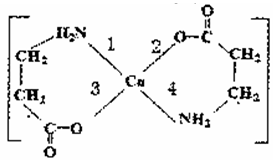
(3)基态Cu2+的外围电子排布式为__。
(4)二甘氨酸合铜( II)中,第一电离能最大的元素与电负性最小的非金属元素可形成多种微粒,其中一种是5核10电子的微粒,该微粒的空间构型是_。
(5)lmol二甘氨酸合铜(II)含有的二键数目是_。
(6)二甘氨酸合铜(II)结构中,与铜形成的化学键中一定属于配位键的是____ (填写编号)。
无水硝酸铜极易吸水,加热到210℃升华,它和Cu(NO3)2 ·3H2O晶体的化学性质有较大差异, Cu(NO3)2 ·3H2O晶体加热到170℃分解。已知:乙酸乙酯的沸点为77 ℃。
(1)加热蒸干Cu(NO3)2 溶液得不到无水硝酸铜的原因是_____________。
(2)将铜片加人到N2 O 4的乙酸乙酯溶液中可制得无水硝酸铜,同时生成NO,写出反应的化学方程式_____________;从乙酸乙醋中分离出无水硝酸铜的实验操作是_____________。
(3)为探究Cu(NO3)2 ·3H2O受热分解的产物,某探究小组利用下图装置进行实验。(图中夹持和加热装置去)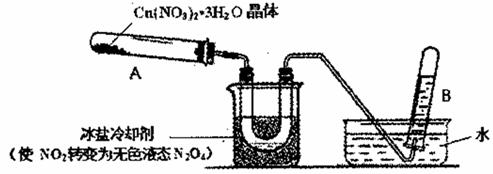
往试管A中加人研细的Cu(NO3)2 ·3H2O体并加热,观察到试管A中有红棕色气生成,最终残留黑色粉末;U型管中有液体生成,在试管B中收集到无色气体。
①当导管口不再有气池冒出时,反应停止,拆除装置的操作首先是______。
②试管B中收集到的气体一定含有______。
(4)锌与Cu(NO3)2溶液能发生反应。在一支试管中注人1 mol·L-1的Cu(NO3)2溶液,再放入一块锌片,观察到在反应初期有大量无色气泡冒出,同时锌片上析出红色固体。该小组猜想气体的成分,并设计的实验步骤,请填写下表。