铝在空气中能够稳定存在的原因是( )
| A.铝的活泼性差 | B.铝的还原性差 |
| C.铝与氧气不反应 | D.铝表面有氧化膜 |
在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)  CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0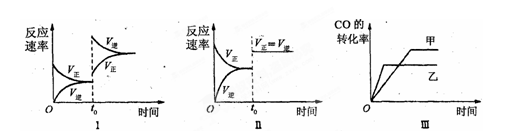
下列分析中正确的是
| A.图Ⅰ研究中的是t0时增大反应物浓度对反应速率的影响 |
| B.图Ⅱ研究的是t0时增大压强(缩小体积)或使用催化剂对反应速率的影响 |
| C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂 |
| D.图Ⅲ研究的是温度对化学平衡的影响,且甲的温度较高 |
下列叙述正确的是









| A.在原电池的负极和电解池的阴极上都是发生失电子的氧化反应 |
| B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 |
| C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH |
| D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
下列有关热化学方程式的叙述正确的是
| A.在101Kpa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=+285.8KJ/mol |
| B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)==2CO(g)+O2(g)反应的 △H=2×283.0kJ/mol |
C.在稀溶液中H+(aq)+OH-(aq)  H2O(l) △H=-57.2 kJ/mol 若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的稀溶液混合,放出的热量等于57.2 kJ H2O(l) △H=-57.2 kJ/mol 若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的稀溶液混合,放出的热量等于57.2 kJ |
D.己知2H2(g)+O2(g) 2H2O(l)△H1 , 2H2O(l)△H1 , |
2H2(g)+O2(g) 2H2O(g)△H2 ,则△H1 > △H2
2H2O(g)△H2 ,则△H1 > △H2
一定条件下,在一恒容密闭容器中,能表示反应 X(g) + 2Y(g)  2Z(g) 一定达到化学平衡状态的是
2Z(g) 一定达到化学平衡状态的是
①容器中气体的密度不再发生变化② X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化④单位时间内生成n mol Z,同时生成2n mol Y
| A.①② | B.②③ | C.③④ | D.①④ |
在0.1mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH  CH3COO-+H+对于该平衡,下列叙述正确的是
CH3COO-+H+对于该平衡,下列叙述正确的是
| A.加水,平衡向逆反应方向移动,CH3COOH电离度减小 |
| B.滴加少量0.1mol/L HCl溶液,溶液中C(H+)减少 |
| C.加入少量NaOH固体,平衡向正反应方向移动 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |