已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是( )
| A.2C2H2(g)+5O2(g)====4CO2(g)+2H2O(l) ΔH="-4b" kJ·mol-1 |
B.C2H2(g)+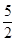 O2(g)====2CO2(g)+H2O(l) ΔH="2b" kJ·mol-1 O2(g)====2CO2(g)+H2O(l) ΔH="2b" kJ·mol-1 |
| C.2C2H2(g)+5O2(g) ====4CO2(g)+2H2O(l) ΔH="-2b" kJ·mol-1 |
| D.2C2H2(g)+5O2(g) ====4CO2(g)+2H2O(l) ΔH="b" kJ·mol-1 |
已知:①2C(s)+O2(g)===2CO(g) ΔH1 ②2CO(g)+O2(g)===2CO2(g) ΔH2
下列说法中正确的是
| A.碳的燃烧热ΔH为0.5ΔH1kJ·mol-1 | B.②能表示CO燃烧热的热化学方程式 |
| C.碳的燃烧热ΔH=0.5(ΔH1+ΔH2) | D.碳的燃烧热小于CO的燃烧热 |
已知(1)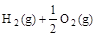 ===H2O(g)△H1=a kJ·
===H2O(g)△H1=a kJ·
(2)  ===2H2O(g)△H2=b kJ·
===2H2O(g)△H2=b kJ·
(3) 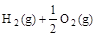 ===H2O(l)△H3=c kJ·
===H2O(l)△H3=c kJ·
(4)  ===2H2O(l)△H4=d kJ·
===2H2O(l)△H4=d kJ·
下列关系式中正确的是
| A.a<c <0 | B.b>d>0 | C.2a=b<0 | D.2c=d>0 |
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O===O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中1 mol H—H键断裂时吸收热量为
| A.920 kJ | B.557 kJ | C.436 kJ | D.188 kJ |
S(单斜)和S(正交)是硫的两种同素异形体。
已知:①S(单斜,s)+O2(g)===SO2(g)ΔH1=-297.16 kJ·mol-1
②S(正交,s)+O2(g)===SO2(g)ΔH2=-296.83 kJ·mol-1
③S(单斜,s)===S(正交,s) ΔH3
下列说法正确的是
| A.ΔH3=+0.33 kJ·mol-1 |
| B.单斜硫转化为正交硫的反应是吸热反应 |
| C.S(单斜,s)===S(正交,s) ΔH3<0,正交硫比单斜硫稳定 |
| D.S(单斜,s)===S(正交,s) ΔH3>0,单斜硫比正交硫稳定 |
25℃、101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ·mol-1,辛烷的燃烧热为5518 kJ·mol-1。下列热化学方程式书写正确的是
| A.2H+(aq)+SO42— (aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l) ΔH=-57.3 kJ·mol-1 |
| B.KOH(aq)+1/2H2SO4(aq)==="1/2" K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1 |
| C.C8H18(l)+25/2O2(g)===8CO2(g)+9H2O(g)ΔH=-5518 kJ·mol-1 |
| D.2C8H18(g)+25O2(g)===16CO2(g)+18H2O(l)ΔH=-5518 kJ·mol-1 |