一定温度下,在2L恒容密闭容器中发生反应:2N2O5(g)  4NO2(g)+ O2(g),△H﹥0.反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,下列说法正确的是
4NO2(g)+ O2(g),△H﹥0.反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,下列说法正确的是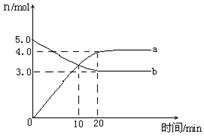
| A.10min时,反应达到平衡 |
| B.该温度下反应的平衡常数为8 |
| C.0~20min内平均反应速率v(N2O5)=0.05mol∙L-1∙min-1 |
| D.曲线a表示NO2的物质的量随反应时间的变化 |
将0.195g锌粉加入到20.0 mL的0.100 mol·L-1 MO2+溶液中,恰好完全反应,则还原产物可能是
| A.M+ | B.M2+ | C.M3+ | D.MO42- |
已知Co2O3在酸性溶液中易被还原生成Co2+。Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是
| A. Co2O3+2Fe2++6H+===2Fe3++2Co2++3H2O |
| B.Cl2+FeI2===FeCl2+I2 |
| C.Co2O3+6HCl===2CoCl2+Cl2↑+3H2O |
| D.3Cl2+6FeI2===2FeCl3+4FeI3 |
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是
| A.2Na2O2+2H2O=4NaOH+O2↑ | B.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| C.2F2+2H2O=4HF+O2 | D.Cl2+H2O="HCl+" HClO |
某无土栽培用的营养液,要求KCl、K2SO4和NH4Cl 三种固体原料的物质的量之比为1:4:8。若配制该营养液,取528g (NH4)2 SO4,则需KCl的质量为
| A.670.5g | B.74.5g | C.596g | D.149g |
当光束通过下列分散系:①有尘埃的空气②稀硫酸③蒸馏水④墨水⑤稀豆浆,能观察到丁达尔效应的是
| A.①④⑤ | B.②③⑤ | C.①②⑤ | D.①②④ |