某有机物B的分子式为C4H4O4,其结构简式为HOOCCH=CHCOOH
(1)B分子所含官能团的名称是 、 。
(2)1mol C4H4O4完全燃烧需消耗O2 __ __ mol。
(3)与B的具有相同官能团的同分异构体的结构简式是 。
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| 实 验 步 骤 |
解 释 或 实 验 结 论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空: (1)A的相对分子质量为:。 |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 |
(2)A的分子式为: 。 |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 |
(3)用结构简式表示A中含有的官能团: 。 |
(4)A的核磁共振氢谱如下图: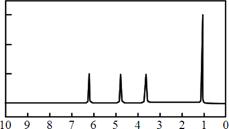 |
(4)A中含有种氢原子。 |
| (5)综上所述,A的结构简式。 |
A、B、C三种有机物的分子式均为C3H6O2,分子中都含有甲基。做有关实验并记录反应情况如下表:
| NaOH溶液 |
银氨溶液,加热 |
新制Cu(OH)2 |
金属钠 |
|
| A |
中和反应 |
无银镜 |
溶解 |
产生氢气 |
| B |
不反应 |
有银镜 |
加热,有红色沉淀 |
产生氢气 |
| C |
水解反应 |
有银镜 |
加热,有红色沉淀 |
不反应 |
则A、B、C三种有机物的结构简式分别为:
A_______________________,B_________________________,C_______________________________。
硫酸亚铁铵【(NH4)2Fe(SO4)2】俗称莫尔盐,工业上用途广泛,该物质属于。
A、酸B、碱 C、盐
某同学为了验证硫酸亚铁铵晶体中的阳离子,进行了如下操作。
(1)室温下,将少量的硫酸亚铁铵晶体配成溶液,并将所配溶液分置于两支试管中,用其中一支进行验证Fe2+的实验,请完成下表:
| 操作 |
①往试管中滴入几滴溶液(填化学式) |
②继续滴入几滴新制氯水 |
| 现象 |
溶液无明显变化 |
溶液显红色 |
| 原因 |
溶液中没有Fe3+ |
(用简要文字说明原因) |
(2)为了验证NH4+该同学往另一支试管中滴加过量的浓氢氧化钠溶液并加热,并在试管口用湿润的红色石蕊试纸检验反应产物,红色石蕊试纸变蓝,同时试管内有红褐色固体产生,则加热时试管内反应的离子方程式是。
甲、乙两同学在实验室分别取用不同试剂来制取Al(OH)3【可选试剂有:AlCl3溶液、A12(SO4)3溶液、NaOH溶液、氨水】。
(1)请完成下表:
| 甲同学 |
乙同学 |
|
| 选用试剂 |
A1C13溶液、NaOH溶液 |
A12(SO4)3溶液、氨水 |
| 操作 |
向AlCl3溶液中逐滴加入NaOH溶液至过量 |
向A12(SO4)3溶液中逐滴加入氨水至过量 |
| 实验现象 |
||
| 化学方程式 |
A12(SO4)3+6NH3·H2O=2A1(OH)3 ↓+3(NH4)2SO4 |
|
| 离子方程式 |
(2)若是你来制取Al(OH)3,试剂组合还可以是。
(3)由甲、乙两同学的实验现象你能得出的结论有(用简要文字说明)。
根据下列转化关系以及现象回答: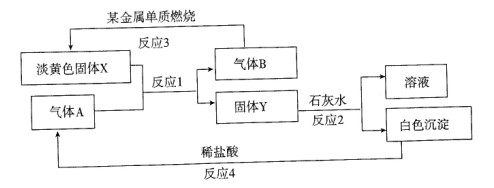
(1)固体X的名称是,Y的化学式是。
(2)写出反应l的化学方程式。
(3)写出反应2的化学方程式。
(4)若15.6g X和足量水反应,转移mol e-。